【衡道丨文献】肺良性肿瘤总结
时间:2024-10-20 06:04:32 热度:37.1℃ 作者:网络
美国梅奥医学中心的Jennifer M Boland博士在病理学知名期刊《Histopathology》上发表题为“What’s new in benign lung tumours?”的综述性文章,详尽阐述了常见良性肺肿瘤的临床病理特点及分子遗传学特点。

本期甘肃省人民医院病理科陈旭老师将这篇综述要点编译如下,供相关医师参考。
肺腺瘤
细支气管腺瘤/纤毛黏液结节性乳头状肿瘤
纤毛黏液结节性乳头状肿瘤(CMPTs)最初被描述为罕见的周围性肺良性肿瘤,好发生于东亚人群。组织学包含黏液细胞、纤毛细胞和基底细胞三种成分,这些细胞以纤维血管为轴心,呈乳头状排列。CMPT伴鳞状化生时易与鳞状细胞癌相混淆,两者TTF-1的表达模式不同,CMPT的基底细胞呈线性表达p40和p63。CMPT体积很小(5-15mm),通常可见中央不对称的动脉,肿瘤周围可见粘蛋白和慢性炎症。CMPT具有相当显著的形态变异性,并非所有的病例都包含所有经典的组织学特征。有些病例组织学是扁平的,没有乳头状结构,病变可能不包含所有特征性上皮成分(如黏液细胞、纤毛细胞)。因此,专家针对这些肿瘤,提出了新的术语“细支气管腺瘤(BA)”。目前2021年WHO分类将其命名为细支气管腺瘤/纤毛黏液结节性乳头状肿瘤(BA/CMPT)。
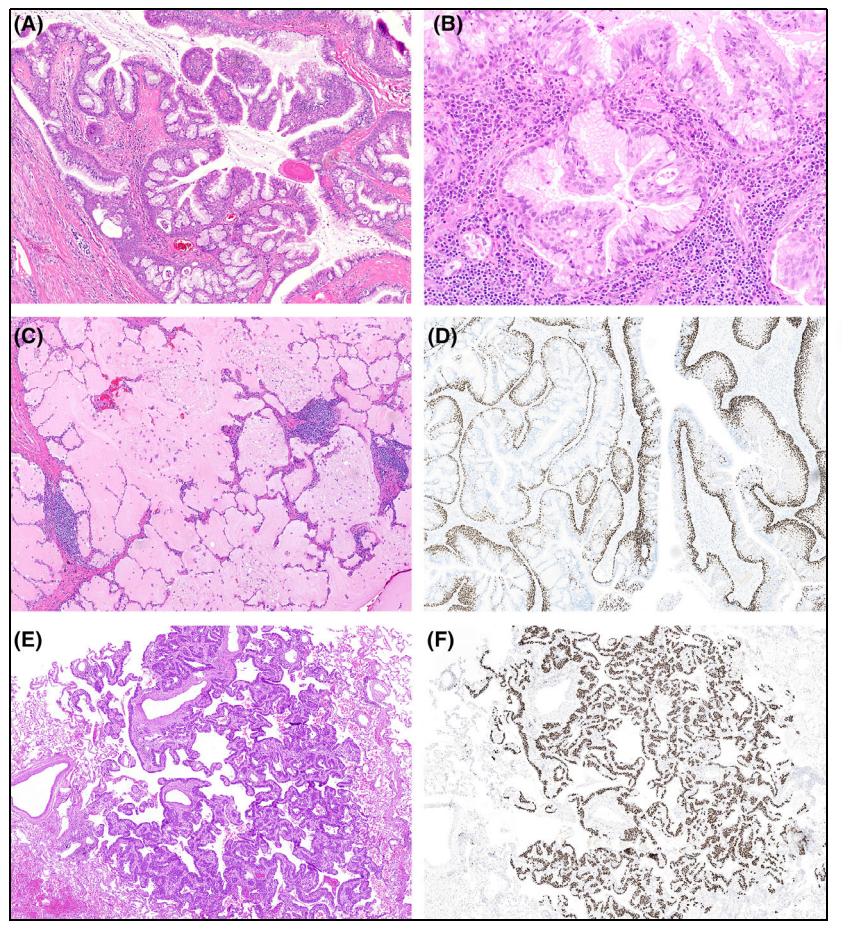
图1:细支气管腺瘤/纤毛黏液结节性乳头状肿瘤。近端型,肿瘤伴有乳头状结构(A),黏液和纤毛细胞(B)混合,丰富的邻近肺泡内粘蛋白伴慢性炎症(C)和连续层的P40阳性基底细胞(D)。远端型肿瘤显示部分纤毛柱状细胞的扁平结节状细支气管周围增生(E),可见一层连续的p63阳性细胞,局部多层,符合基底细胞增生(F)。
BA/ CMPT需与腺癌相鉴别,在BA/CMPT中,可见明确的基底细胞层,无明显的核异型性。在BA/CMPT的冰冻切片中,基底细胞增生的鉴别较为困难,基底细胞可能变成多层细胞,但缺乏异型性。混合纤毛细胞的存在、核异型性的缺乏和p40阳性基底细胞的线性排列,有助于将其与腺癌相区分。远端型BA/CMPT可能难以与细支气管化生区分。然而,细支气管化生通常是一个更弥漫性的过程,涉及许多小气道改变。
分子遗传学上,BA/CMPT可见BRAF、EGFR、KRAS、HRAS、ALK和AKT1突变。BRAF是BA/CMPT中最常见的遗传驱动因素,以BRAF V600E突变最为常见。
硬化性肺细胞瘤(SP)
硬化性肺细胞瘤通常在肺周围形成局限的孤立性结节,在支气管中较少见。SP好发于女性,多灶性病变、复发和转移罕见。SP具有明显的异质性结构,可表现为扩张性血管结构、乳头状、腺泡状结构、实体生长和明显的间质硬化区域。组织学最明显的特征是可见双细胞群,乳头和腺泡结构由上皮细胞排列组成,其形态和免疫表型与2型肺泡上皮细胞非常相似,表达角蛋白、EMA、TTF-1和Napsin。2型肺泡上皮细胞样细胞虽然形态温和,但可显示中度异型性的局灶性区域,间质中可见圆形细胞,通常与胶原硬化的区域有关。这些细胞的细胞核从圆形到卵圆形,细胞质较少。
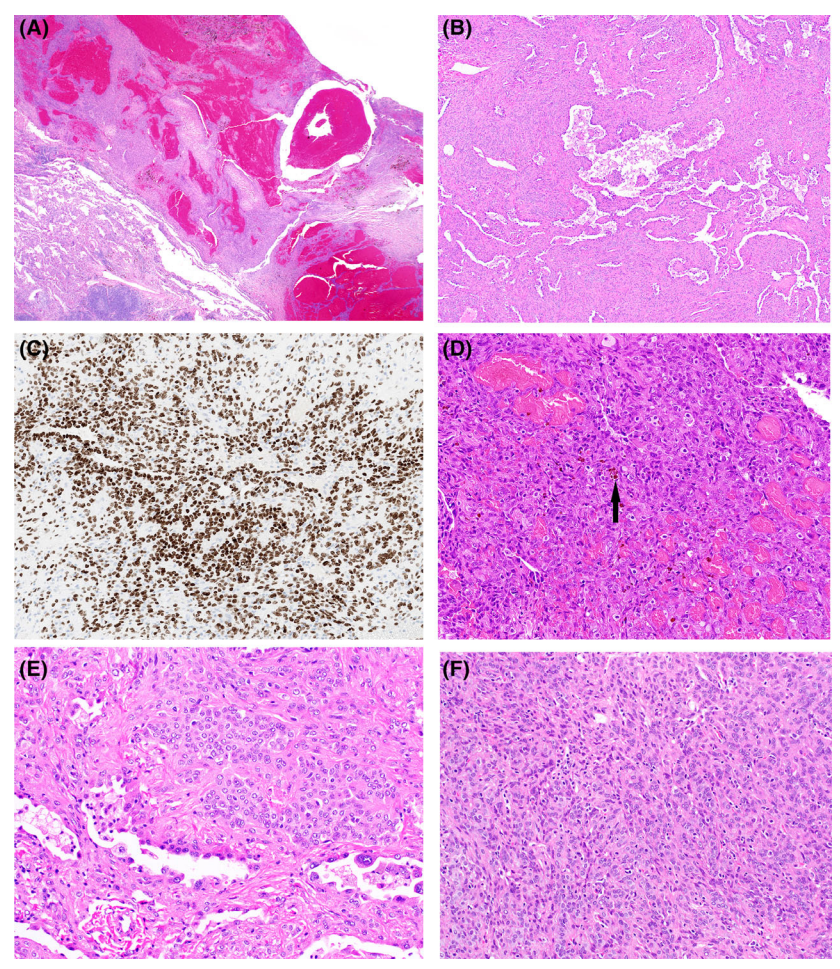
图2. 硬化性肺细胞瘤。低倍镜下,可见血管腔样(A)以及乳头状、腺泡和实性结构(B)。高倍镜下可见两种细胞群,一种是类似于2型肺细胞的腺泡和乳头状结构,另一种是硬化背景下的间质温和的圆形细胞,它们都表达TTF-1(C)。血管腔样结构可显示邻近的增生性病变(D,箭头)。内衬细胞可见局灶不典型,出现核增大、深染(E,底部),但通常圆形细胞是形态一致、单一的(F)。
硬化性肺细胞瘤的异质性形态可导致与其他几种肿瘤的混淆,特别是在小活检或冰冻切片上。乳头状和腺泡结构,可能与肺腺癌相混淆,肺腺癌也具有相似的免疫表型,因此识别圆形间质细胞和缺乏明显的细胞异型性,是区分SP和腺癌的关键。间质圆形细胞可与类癌肿瘤或上皮样血管内皮瘤相混淆,可通过免疫组化相鉴别。
分子遗传学上,硬化性肺细胞瘤经常出现AKT1基因的异常,包括内部串联复制、热点点突变(特别是E17K)和插入。极少数SP显示BRAF V600E突变。
肺泡腺瘤
肺泡腺瘤较为罕见,大多数肿瘤直径<3cm,个别病例肿瘤>10cm,表现为良性病程。肺泡腺瘤由温和的梭形间充质细胞组成,间质轻度扩张,伴有扩张的肺泡样间隙,周围有形态学和免疫表型与2型肺细胞对应的细胞。病变边界非常清楚,与相邻肺的界面通常呈圆形轮廓。扩张的气隙有时会变成囊性的,并经常含有颗粒状的嗜酸性碎片。间质细胞可表达SMA和CD34,很少表达S100,而囊性肺泡间隙的细胞表达角蛋白、EMA和TTF 1。
肺泡腺瘤常误诊为血管肿瘤、硬化性肺细胞瘤、淋巴管肌瘤病(LAM)或类癌,这可通过免疫组化来鉴别。低级别间叶源性肿瘤可以转移到肺部,经常可见囊性改变(子宫内膜间质肉瘤、纤维组织细胞肿瘤等),然而转移性疾病通常多灶性肺受累。突出的间质梭形细胞和清晰的边界(通常为圆形轮廓),可将肺泡腺瘤与贴壁生长的腺癌区分开来。
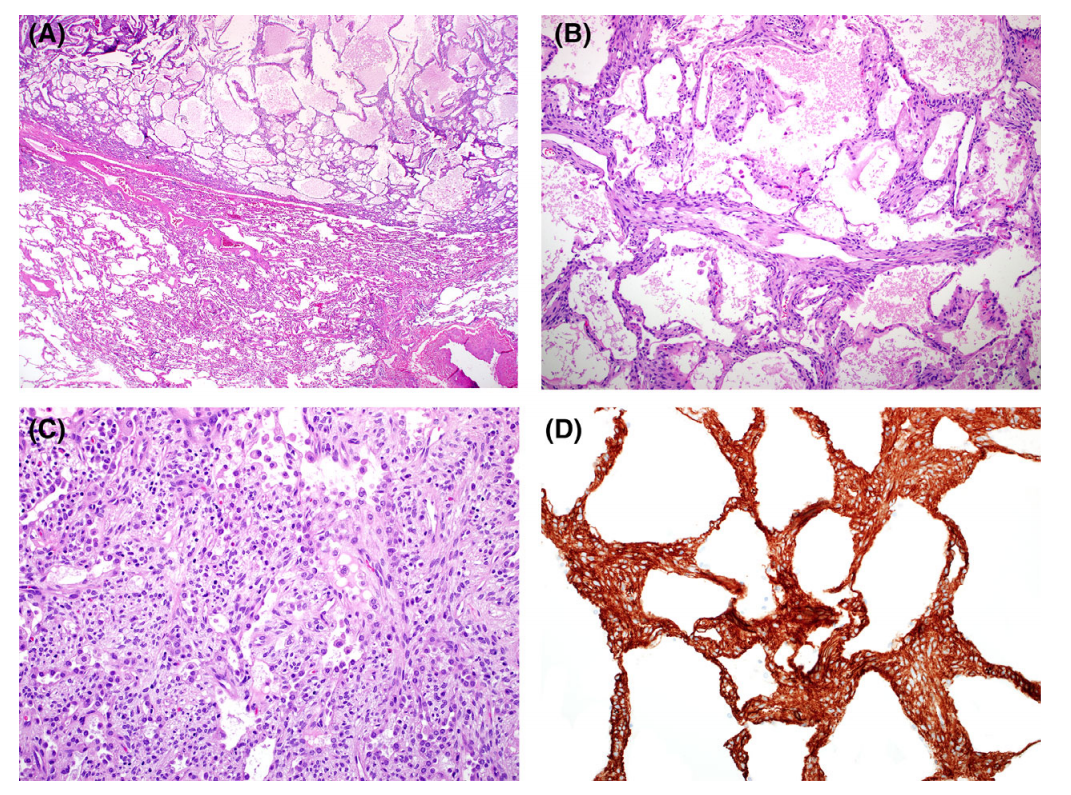
图3.肺泡腺瘤。多囊外观的肿瘤(A,上)与肺实质(A,底部)。囊性间隙内衬肺泡上皮样细胞,囊腔内有嗜酸性颗粒状物质(B),间质中温和的梭形细胞,局部可融合(C)间质细胞可表达CD34 (D)。
支气管乳头状瘤
乳头状瘤在肺中极为罕见,它们只发生在支气管内或较少见的细支气管内部位。它们的特征是宽的纤维血管轴心,内衬着温和的良性上皮。乳头状瘤可以根据观察到的上皮类型分为分类,分为鳞状上皮、腺上皮或混合上皮(鳞状和腺状成分各构成至少三分之一的上皮)。它们通常发生在成人中,鳞状上皮和混合上皮乳头状瘤都以男性为主。由于好发于大气道,症状可能包括咯血、咳嗽或阻塞性后肺炎。鳞状乳头状瘤轴心衬附鳞状上皮,有序成熟,可能包含上皮内中性粒细胞,可能显示有丝分裂活性、轻度核不典型性和表面角化。混合乳头状瘤和腺性乳头状瘤的典型腺成分由非纤毛柱状或立方细胞组成,黏液细胞散布,通常不表现出有丝分裂活性或显著的核异型性。
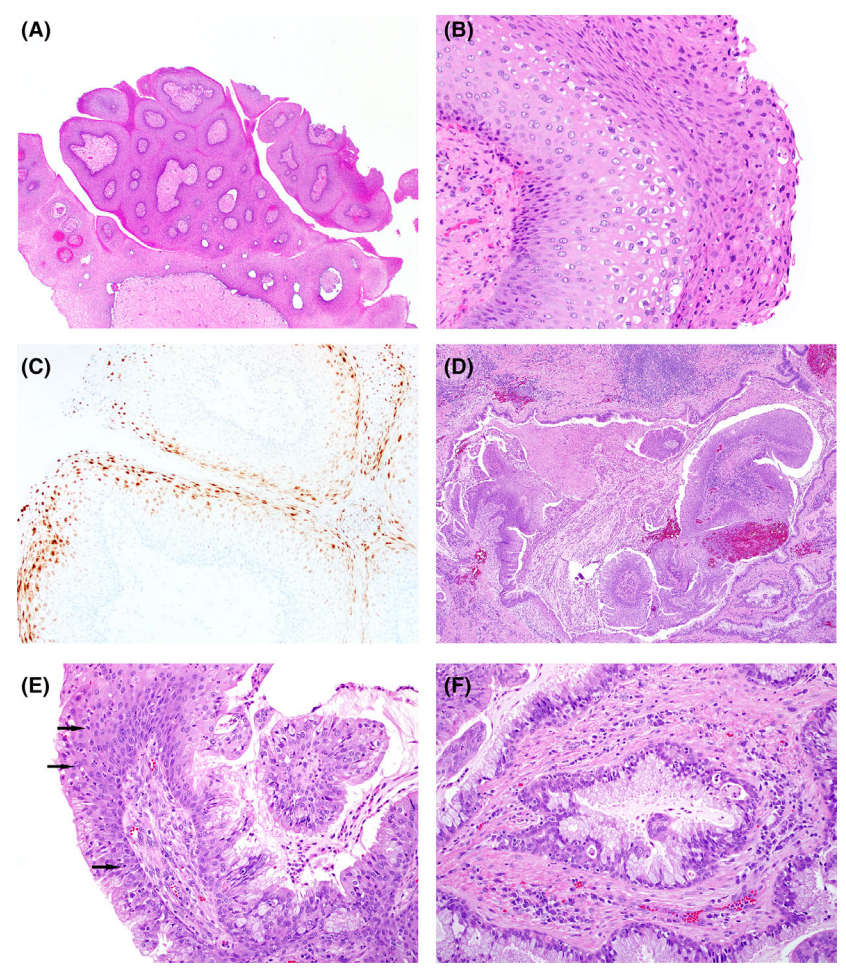
图4.支气管乳头状瘤。支气管(A)内鳞状乳头状瘤显示空泡细胞改变灶和基础有丝分裂活性(B),HPV原位杂交(C)显示低风险HPV阳性,发生于支气管(D)中的混合腺状和鳞状乳头状瘤,显示鳞状上皮增生,向腺状上皮过渡中,中性粒细胞逐渐增多(E,箭头向中性粒细胞过渡),局灶伴有黏液分化(F)。
部分鳞状上皮乳头状瘤与HPV感染相关,约5-9%的病例可扩展到下呼吸道,可引起严重的并发症。孤立性鳞状上皮乳头状瘤只有不到一半的病例与HPV相关,但这种潜在的关联,应需要在所有支气管内鳞状上皮乳头状瘤中进行HPV检测。在影像学上,HPV相关的乳头状瘤可伴有多发性进行性薄而厚壁的空洞性和囊性肺肿块或多个小叶中心结节。
组织学上,乳头状瘤可从气道扩散到邻近的肺泡腔,并伴有明显的纤维蛋白炎症变化;这些模式不应与侵袭性生长模式相混淆。鳞状乳头状瘤也常表现为反向生长,不应与侵袭相混淆。
具有乳头状/外生性生长的支气管内鳞状细胞癌易与鳞状乳头状瘤相混淆。乳头状鳞状细胞癌通常表现为全层鳞状异型性,伴有上皮组织紊乱、核增大和深染、凋亡碎片、大量的有丝分裂象。黏液表皮样癌易误诊为混合性乳头状瘤,但典型的表现为实体生长,没有明显的乳头状结构。检测到MAML2基因重排是黏液表皮样癌的遗传特征。乳头状腺癌和黏液腺癌可误诊为腺性乳头状瘤,因为与其他亚型腺癌相比,它们往往表现出较不明显的核非典型性和浸润性的促结缔组织生长。与真正的乳头状瘤的宽乳头相比,腺癌也经常有更细的纤维血管轴心和更小的乳头状结构。
良性肺间叶源性肿瘤
肺错构瘤
肺错构瘤是最常见的良性肺肿瘤,通常具有两种或两种以上的间充质成分和内陷的支气管上皮。好发于肺周围,但也可能位于支气管内,男性多见。影像学表现为局限性孤立性结节。肿瘤直径常<4cm,个别病例>10cm,多发性错构瘤罕见。
组织学上,间叶成分最典型的是透明软骨,常伴有成熟的脂肪组织和温和的黏液样梭形细胞间质。平滑肌及骨骼肌少见。错构瘤偶尔也会表现出其他形态学变异,包括丰富的脂肪组织(脂肪瘤样),或有明显的纤维或平滑肌成分。富含软骨的错构瘤有时很难与肺软骨瘤区分,典型的内陷的支气管上皮,支持错构瘤的诊断,因为软骨瘤通常由纯透明软骨组成,有纤维性假包囊,而不是内陷的支气管上皮。转移性肉瘤,无论是转移性软骨肉瘤还是转移性黏液样肉瘤,错构瘤的异型性比典型的肉瘤要少得多。临床病史也是最重要的,因为原发性肺软骨肉瘤非常罕见,而且软骨肉瘤转移通常只发生在有中度至高级别软骨肉瘤病史的患者中。在分子遗传学上,肺错构瘤常见HMGA2::LPP融合。
肺软骨瘤
肺软骨瘤极为罕见,其与Carney综合征(肺软骨瘤、胃肠道间质瘤、副神经节瘤)密切相关。虽然肺错构瘤是良性肿瘤,但该三联征的其他肿瘤偶尔可能更具侵袭性,因此准确的分类有助于识别潜在的综合征患者。Carney综合征相关软骨瘤女性多见,患者年龄往往小于30岁。然而,散发性(非Carney综合征相关)软骨瘤往往好发于老年男性。软骨瘤表现为局限性和分叶状肿块,可出现部分钙化。组织学上,软骨瘤的特征是纯成熟的透明软骨,被纤维性假包囊包绕。它们经常表现为黏液样改变和骨化生伴钙化。软骨细胞缺乏异型性。
软骨瘤需与错构瘤相鉴别,在Carney综合征相关软骨瘤中,SDHB经常表达缺失。软骨瘤也需要与转移性软骨肉瘤相鉴别,通常,软骨肉瘤会表现出更显著程度的细胞异型性。
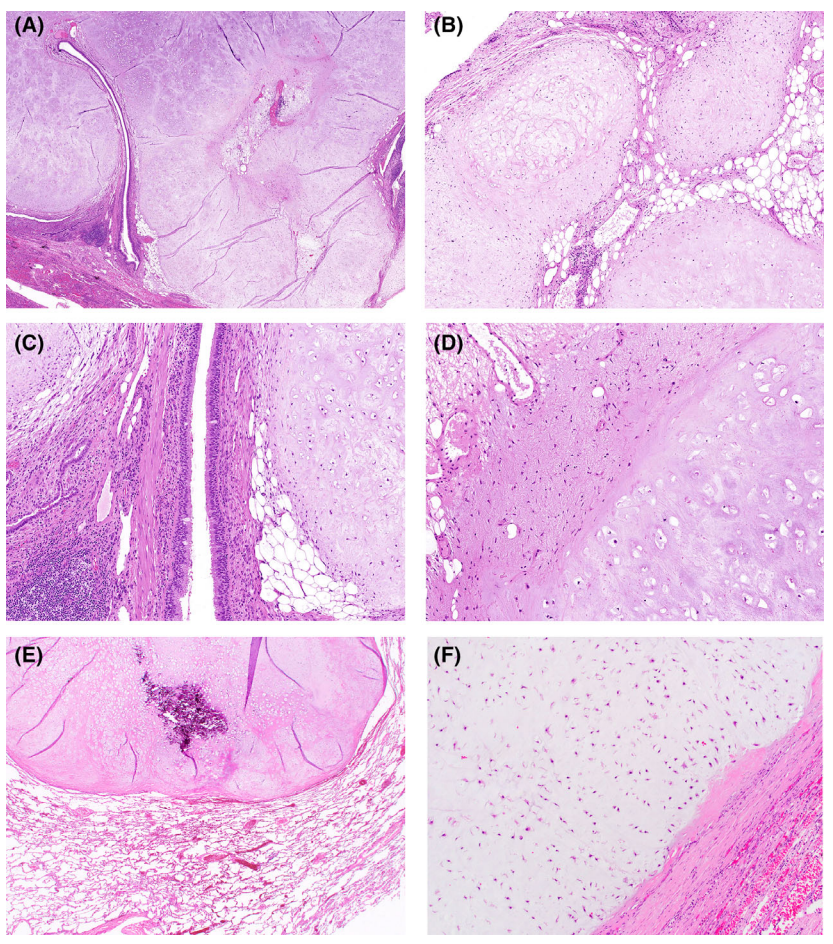
图5. 肺错构瘤和肺软骨瘤。在肺错构瘤中,内陷的支气管上皮(A)和脂肪组织(B)与透明软骨混合,并伴有局灶性平滑肌增生和慢性炎症(C)。黏液样梭形细胞(左上角)也是错构瘤(D)的常见组成部分。低倍镜下,软骨瘤的边缘为纤维性假包囊,缺乏上皮内陷(E),仅由温和的软骨细胞和透明基质组成,没有其他间叶成分(F)。
PEComa
PEComa起源于PEC细胞,而PEC细胞是一种独特的间叶源性细胞,通常与血管壁相关,显示出一种特殊的混合平滑肌和黑色素细胞(“肌黑色素细胞”)表型,表达SMA、Desmin、HMB45和Melan-A。PEComa在肺中较为少见,通常表现为偶然发现的孤立和局限的周围肺结节。肿物多为3-4cm,偶尔有15cm的病例,好发于男性,发病年龄广泛。
肺部PEComa由多边形细胞巢组成,胞浆丰富,透明到颗粒状和苍白的嗜酸性细胞,可见细胞边界,细胞核圆形。细胞核轻度异型,没有明显的多形性。有些细胞会有明显的小核仁。部分肿瘤可见分支血管,核分裂罕见。绝大多数肺部PEComa表现为良性特点,但存在少数恶性病例,这与有丝分裂活性增加、明显的多形性和坏死有关。特别是在有恶性组织病理学特征或多发性肺结节的情况下,应排除肺外转移可能。
肺部PEComa需要与转移性透明细胞肾细胞癌或具有透明细胞改变的类癌肿瘤相鉴别,这可以通过角蛋白、PAX8和神经内分泌标志物(Syn、CgA和INSM1)的免疫组化染色鉴别。
分子遗传学上,大约80%的PEComas显示TSC2基因突变。这导致了异常的mTOR通路信号传递,从而驱动了发病机制。少数病例涉及TFE3的易位。
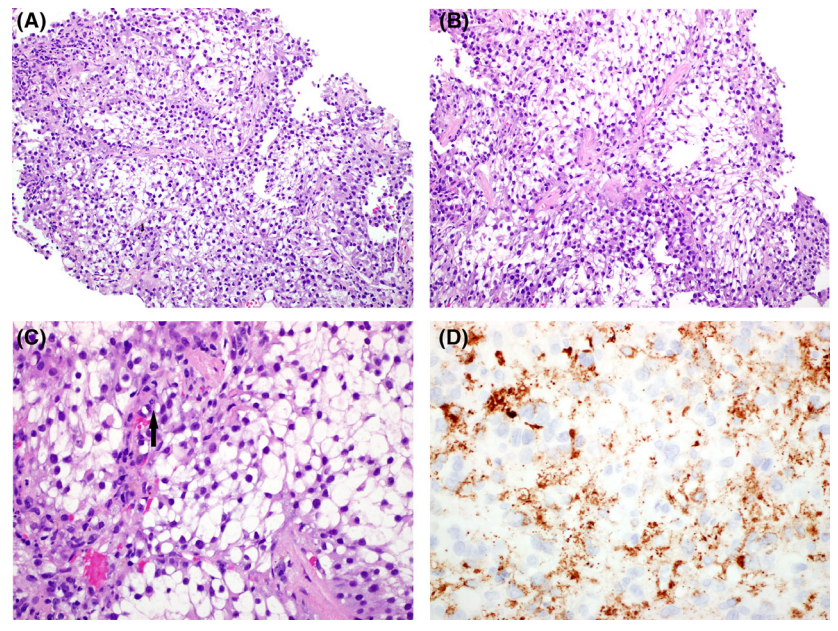
图6.肺PEComa。肿瘤细胞具有丰富的透明胞浆,突出的细胞边界和巢式结构(A),可见分支血管(B),核分裂罕见(C,箭头),肿瘤细胞表达HMB45(D)。
参考文献及书籍:
Boland JM. What's new in benign lung tumours? Histopathology. 2024 Jan;84(1):124-135. doi: 10.1111/his.15037. Epub 2023 Sep 10. PMID: 37691383.


