【衡道丨干货】2024版CSCO卵巢癌指南更新,国内外权威共识指南中的卵巢癌的病理诊断有何异同?
时间:2024-10-23 19:00:49 热度:37.1℃ 作者:网络
卵巢上皮癌病理学诊断
卵巢恶性肿瘤中上皮性癌最常见,占80%~90%,总的5年生存率为40%~50%,中、晚期约30%。上皮性输卵管癌和原发腹膜癌均属于发病率非常低的妇科肿瘤,其生物学行为及治疗原则均同卵巢上皮癌。
一、肿瘤穿刺活检
(一)Ⅰ级推荐:
1、大体:
组织样本大小和数目
2、镜下:
明确病变性质和类型,肿瘤/非肿瘤,良性/恶性;组织学类型;组织学分级
(二)Ⅱ级推荐:
免疫组织化学/分子标志物:
用于鉴别诊断的免疫组化标志物检测
二、卵巢癌分期/减瘤术标本
(一)Ⅰ级推荐:
1、大体:
肿瘤部位;肿瘤大小;肿瘤切面,有无坏死;双侧附件大小、切面是否正常,表面受累情况;淋巴结检出数目、大小和分组
2、镜下:
组织学类型;组织学分级;脉管侵犯;神经侵犯;双侧附件区是否受累,其他累及部位;淋巴结转移数和癌结节数;TNM分期;肿瘤化疗反应程度
3、免疫组织化学/分子标志物:
胚系/体细胞BRCA1/2等同源重组修复通路基因突变检测
(二)Ⅱ级推荐:
免疫组织化学/分子标志物:
用于鉴别诊断的免疫组化标志物检测;同源重组修复缺陷(HRD)
Lynch综合征的筛查
复发时:微卫星不稳定(MSI)或错配修复缺陷(dMMR)、肿瘤突变负荷(TMB);BRAF突变、FRα表达、HER2表达、ER表达、PR表达、RET融合、NTRK融合(该部分新版指南更新为Ⅱ级推荐)
所有标本应及时固定(离体30min内固定最佳),固定液的量应为组织的10倍,固定时间8~48h。
根据组织病理学、免疫组织化学和分子遗传学分析,上皮性卵巢癌、输卵管癌和腹膜癌的5个主要亚型及其所占比例如下:
-
高级别浆液性癌(high-grade serous carcinoma,HGSC):70%~80%。
-
宫内膜样癌:10%。
-
透明细胞癌:10%。
-
黏液性癌:3%。
-
低级别浆液性癌(low-grade serous carcinoma,LGSC):<5%。
HGSC是卵巢癌、输卵管癌和腹膜癌最常见的类型。HGSC的关键特征是明显的细胞异型性,伴突出的核分裂活性。异型性细胞核呈深染,且大小变为原来的3倍及以上,常见肿瘤巨细胞。核分裂率通常很高,阈值界定为每10个高倍镜视野(high powered field,HPF)的核分裂象≥12个;如果核分裂象少,则必须考虑LGSC或其他诊断。分子学证据提示移行细胞癌不再是单独的病理类型,而是HGSC的一个亚型,其上皮在形态学上类似于恶性尿路上皮。癌肉瘤及未分化癌被认为是卵巢癌的罕见亚型,其内上皮成分常为高级别浆液性癌,恶性程度高。
LGSC与HGSC的生物学行为不同,它们生长缓慢、肿瘤呈惰性,且对以铂类为基础的化疗相对不敏感。LGSC可以是实质性的或囊性的,囊内或表面可有许多易碎的乳头状赘生物。LGSC由小乳头组成,被覆的肿瘤细胞核大小均一,尺寸变化程度不到3倍。细胞核大小均一是鉴别LGSC与HGSC的特征之一,已被证明具有高度可重复性。LGSC另一个显著特点是其核分裂活性远远低于HGSC,核分裂象<12个/10HPF。LGSC通常伴随非浸润性浆液性交界性成分。交界性浆液性肿瘤比LGSC更常见,LGSC最可能反映浆液性交界性肿瘤的进展。
卵巢宫内膜样癌多为低级别,易被早期发现,并且对铂类化疗相对敏感。这些因素使其预后通常优于浆液性癌。卵巢宫内膜样癌的肉眼表现多样,可能是囊性或实性的。组织学上,卵巢的宫内膜样癌类似子宫内膜癌的低级别宫内膜样腺癌。大多数卵巢宫内膜样癌具有复杂的腺状、筛状和/或绒毛腺状结构,呈背靠背生长、细长形或圆形腺体,管腔光滑。在这些病例中,必须明确原发灶是在卵巢还是在子宫,或者是双原发肿瘤。卵巢宫内膜样癌和透明细胞癌都与卵巢子宫内膜异位症和腺纤维瘤有关。
卵巢原发性黏液性癌少见,通常发生于单侧卵巢,年轻女性较常见,多数病例为早期,通常不引起腹膜假黏液瘤。其他卵巢黏液性肿瘤占所有卵巢肿瘤的10%~15%,包括良性黏液性囊腺瘤、黏液性交界性肿瘤和转移性肿瘤。累及双侧卵巢、侵及表面且不局限于卵巢的黏液性肿瘤几乎都是转移性病变,通常来自胃肠道。
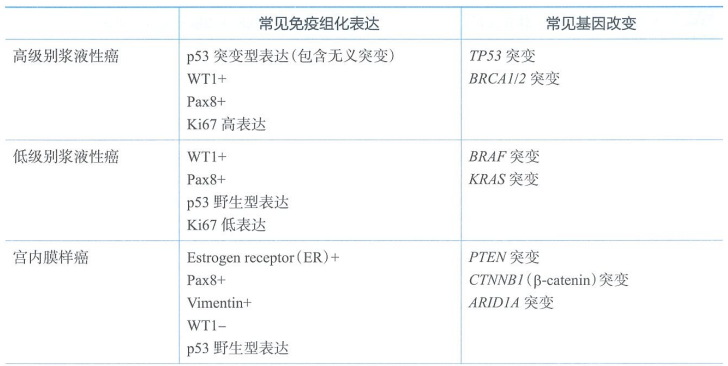
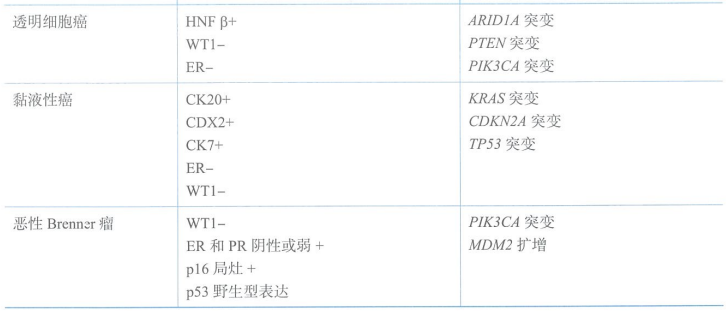
恶性Brenner肿瘤罕见,常发生在50岁以上的女性,具有尿路上皮分化的恶性肿瘤,背景中可见良性或交界Brenner肿瘤成分。不同的组织学亚型,其免疫组织化学、分子生物学和预后也各不相同。HGSC通常具有TP53和BRCA突变。LGSC经常携带KRAS和BRAF突变。不同组织学亚型常见的免疫组织化学表现和基因突变见下表。
常见卵巢癌病理类型及相关免疫组化及基因改变特点
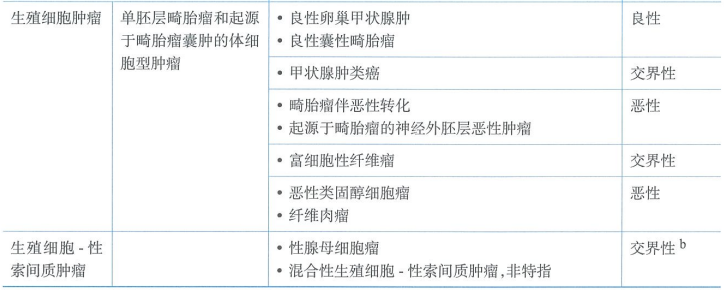
卵巢恶性生殖细胞肿瘤
卵巢恶性生殖细胞肿瘤是一种少见的卵巢恶性肿瘤,占所有卵巢恶性肿瘤的2%~3%,但在亚洲人群中占到15%。好发于儿童、青少年和年轻女性,中位诊断年龄是16~20岁,特殊部位的恶性生殖细胞肿瘤常发生于初潮前的幼女。病理类型包括无性细胞瘤、未成熟畸胎瘤、胚胎癌、卵黄囊瘤和与妊娠无关的绒癌等,主要根据形态特点进行诊断。
2020第5版WHO卵巢肿瘤组织病理学分类

卵巢性索间质肿瘤
卵巢性索间质肿瘤约占卵巢恶性肿瘤的5%,是卵巢肿瘤主要亚型中最少见的一种。大多数卵巢性索间质肿瘤局限于一侧卵巢,具有低度恶性潜能。
2020第5版WHO卵巢肿瘤组织病理学分类
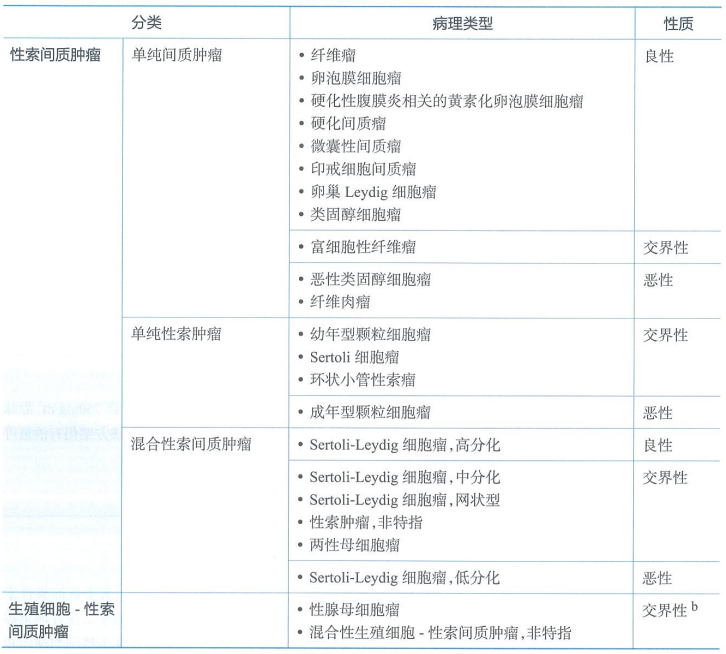
注:混合性生殖细胞-性索间质肿瘤罕见,肿瘤性质需根据具体肿瘤成分确定。
性索间质肿瘤以形态学诊断为基础,分子检测有助于鉴别诊断。粒层细胞肿瘤中,成年型(AGCT)和幼年型粒层细胞瘤(JGCT)的生物学行为不同,已知90%以上的AGCT病例中含有体细胞FOXL2突变,在60%和30%的JGCT中检测到AKT1和GNAS的激活改变(gsp突变)。Sertoli-Leydig细胞肿瘤中分为三个不同的亚型:DICER1突变型(患者年龄较小,中低分化的肿瘤,网状或异源性成分)、FOXL2突变型(绝经后患者,中-低分化肿瘤,无网状或异源性成分)和DICER1/FOXL2野生型(患者年龄中等,无网状或异源性成分,一般分化良好)。另外,微囊性间质瘤含有CTNNB1或较少见的APC突变,并可能偶尔是家族性腺瘤性息肉病的结肠外表现。诊断困难时,相关的分子检测有助于精确分类。
卵巢上皮性交界性肿瘤病理学诊断
卵巢上皮性交界性肿瘤(Borderline Ovarian Tumours,BOT)简称卵巢交界瘤,是指在病理形态学特征、生物学行为及预后介于良性和恶性之间的一组低度恶性潜能的卵巢肿瘤,占卵巢上皮性肿瘤的14%~20%。
根据《WHO肿瘤分类》(第5版),卵巢交界瘤组织学分类包括浆液性交界瘤、黏液性交界瘤、子宫内膜样交界瘤、透明细胞交界瘤、交界性Brenner瘤和浆黏液性交界瘤。其中浆液性交界瘤、黏液性交界瘤占90%以上,其余类型少见。
卵巢浆液性交界瘤是一种非浸润性、低级别、增殖性浆液性上皮性肿瘤。肿瘤直径一般>5cm,可能位于囊内(表现为赘生物)和/或外生性伴表面累及,大约1/3病例为双侧性肿瘤。浆液性交界瘤的病理特征:伴有多级分支状乳头或微乳头/筛状模式,低级别细胞学特点,增殖占比10%以上,无间质浸润。浆液性交界瘤有一个亚型即浆液性交界瘤微乳头亚型。若存在单灶浸润最大径<5mm的浸润灶,应诊断为浆液性交界瘤伴微浸润。种植病灶是指浆液性交界瘤的卵巢外病灶,种植病灶可分为浸润性和非浸润性。如存在浸润性种植,预后与低级别浆液性癌相似。浆液性交界瘤可累及淋巴结,特征类似于非浸润性上皮性种植,并不等同于转移癌,但淋巴结分期为N1。浆液性交界瘤与KRAS和BRAF体系突变有关,是低级别浆液性癌的前驱病变。
卵巢黏液性交界瘤是一种具有胃肠型上皮分化的结构复杂的非浸润性黏液性肿瘤。肿瘤大小平均约20cm,最大可达50cm,几乎总是单侧发生。肿瘤外表面光滑,多房。囊内壁光滑,囊内含有黏液,但也可能有实性区。肿瘤的囊壁被覆胃肠型黏液上皮,具有不同程度的上皮复层化、细胞簇和绒毛状或细长丝状乳头,至少占肿瘤的10%;低级别核异型性;无间质浸润。局灶出现显著细胞异型性,且伴有核分裂象活跃,应考虑上皮内癌的诊断。存在小于5mm的浸润灶,应诊断为黏液性交界瘤伴微浸润,微浸润伴显著细胞异型性应诊断微浸润癌。黏液性交界瘤有时与Brenner瘤或成熟性囊性畸胎瘤并发。卵巢黏液性交界瘤合并腹膜病灶少见,且腹膜病灶大多来源于其他部位(阑尾等)的原发性黏液性肿瘤,卵巢黏液性交界瘤本身罕见累及腹膜。黏液性交界瘤与黏液性癌具有相同的免疫组化表达谱。黏液性交界瘤起源于黏液性囊腺瘤,并可发展为黏液性癌,也可合并皮样囊肿和Brenner瘤。30%~75%的黏液性交界瘤可发现KRAS突变。
与NCCN指南比较
病理学原则
WHO组织学分类
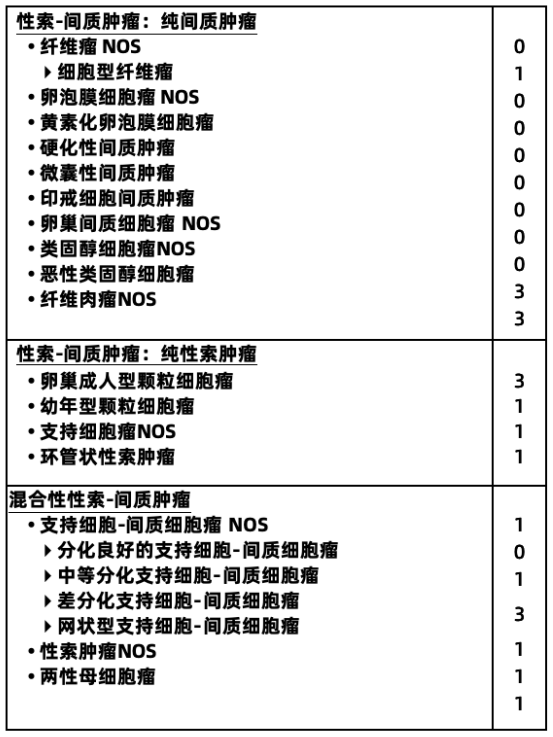
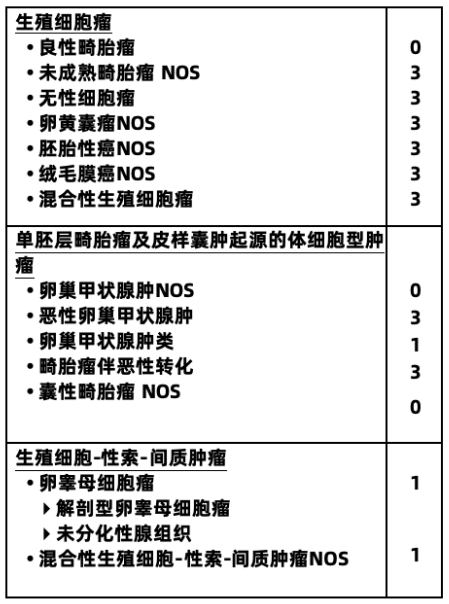

注:编码为0表示良性肿瘤;1表示未特指、交界性或不确定性;2表示原位癌和三级上皮内瘤变;3表示原发部位的恶性肿瘤。
1、包括LCOC在内的大多数卵巢癌,均确诊于活检或手术标本的病理学分析。对于疑似早期疾病的患者,应避免行细针穿刺抽吸(FNA)来诊断卵巢癌以防止囊肿破裂和恶性细胞扩散到腹膜腔。然而,对于不适合进行初次肿瘤细胞减灭术的团块型患者,可能需要进行FNA。
2、原发性腹膜癌和输卵管癌通常在术后(如果卵巢未受主要累及)或术前(如果已进行活检且患者已接受双侧输卵管卵巢切除术)确诊。原发性腹膜癌和输卵管癌的治疗方式与上皮性卵巢癌相同。
3、病理评估应包括以下内容:
-
肿瘤部位(例如,卵巢、输卵管或原发性腹膜)
-
肿瘤大小
-
其他组织/器官受累情况
-
卵巢/输卵管肿瘤:表面受累情况(存在/不存在/无法确定),标本完整性(包膜/浆膜完整/破裂/碎裂)
-
组织学类型和分级
-
扩散和/或种植(如果已采样/已确定)
-
细胞学:腹膜或腹水或冲洗液/胸腔积液
-
淋巴结:检查淋巴结的数量和位置,最大转移灶的大小
-
STIC、子宫内膜异位症(特别是如果与子宫内膜样癌或透明细胞癌连续存在)和/或输卵管上皮化生
-
分期信息(FIGO和TNM)
4、肿瘤分子分析
-
在初始治疗阶段,应选择体细胞检测,以精确识别出能指导使用有确定性获益的干预措施的分子改变,包括在无胚系BRCA突变的情况下,检测BRCA1/2、杂合性缺失(LOH)或同源重组缺陷(HRD)状态。
-
在复发阶段,建议根据具体情况进行肿瘤分子分析,包括检测那些能指导使用具有肿瘤特异性或肿瘤非特异性获益的靶向治疗药物中潜在获益的标志物,包括但不限于HER2状态(通过IHC)、BRCA1/2、HRD状态、微卫星不稳定性(MSI)、错配修复(MMR)、肿瘤突变负荷(TMB)、BRAF、FRα(FOLR1)、RET和NTRK,如果之前的检测未包括这些标志物。对于批准治疗选择有限的不太常见的组织学类型,进行更全面的检测可能尤为重要。建议使用最新可用的肿瘤组织以进行此类检测。
-
当基于组织的分析在临床上不可行时,可以对循环肿瘤DNA(ctDNA或液体活检)进行分子分析。
-
应在CLIA批准的机构中进行经验证的分子检测。
较少见的卵巢癌(LCOC)
交界性肿瘤是一种原发性上皮病变,其细胞学特征提示恶性,但无明确浸润。交界性上皮肿瘤(也称为LMP肿瘤或非典型增生肿瘤)的术语多年来已发生变化。2023年卵巢癌CAP方案使用“交界性”一词,而不使用LMP。交界性上皮肿瘤通常为浆液性或黏液性;也可出现其他组织学亚型,典型上皮性卵巢癌的特征性病理标志是腹膜种植,在显微镜下和/或大体检测时发现腹膜浸润。交界性上皮肿瘤在大体上可能与浸润性癌非常相似。然而,显微镜评估未能发现肿瘤结节明确浸润的证据,尽管病理医生在显微镜下偶尔可识别出具有浸润性种植(这仍然符合交界性上皮病变的诊断)。
透明细胞癌是一种高级别肿瘤,可能源于子宫内膜异位症。大多数透明细胞癌表达napsin A,且WT1和雌激素受体阴性。
基于组织学很难区分原发性黏液性卵巢癌和胃肠道转移癌。PAX8免疫染色是原发性卵巢肿瘤的典型特征,尽管PAX8的缺失并不能排除卵巢作为原发部位的可能性,而SATB2则与结肠起源一致。转移性结直肠腺癌通常也呈CK20和CEA阳性。
子宫内膜样癌可能与子宫内膜异位症有关。子宫内膜样腺癌通常呈细胞角蛋白7(CK7)、PAX8、CA-125和雌激素受体阳性。子宫内膜样肿瘤在外观上也与性索间质肿瘤非常相似。
目前大多数病理学家认为混合性苗勒氏管肿瘤(MMMTs)是分化不良的上皮性卵巢癌(化生癌)的一种亚型。
特殊情况
其他常累及附件的癌症包括:
子宫
宫颈
GI(小肠和大肠、胰腺)
淋巴瘤
对于降低风险的手术,病理评估应包括以下内容:
-
应用SEE-FIM检查输卵管,然后评估是否存在癌症的确切证据。
-
卵巢也应仔细切片、处理和评估。2023年CAP手册中描述了输卵管和卵巢的切片过程。
病理检查结果不明确的患者,或之前被诊断为卵巢癌后被转诊至NCCN成员机构的患者,应由NCCN成员机构的病理医生对其病理结果进行复审。
参考文献及书籍:
1.中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)卵巢癌诊疗指南 2024[M]. 北京 :人民卫生出版社, 2024.
2.NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Ovarian Cancer Including Fallopian Tube Cancer Primary Peritoneal Cancer. Version 2.2024


