新英格兰医学杂志综述:冷球蛋白血症
时间:2024-10-21 14:01:03 热度:37.1℃ 作者:网络
冷球蛋白血症
冷球蛋白是指在低温(4℃以下)时沉淀,复温时又能溶解的一类异常免疫球蛋白(immunoglobulins,Ig),首次发现于1933年。当血清中存在冷球蛋白时,称为冷球蛋白血症,可根据冷球蛋白的种类分为3型:Ⅰ型冷球蛋白血症中,冷球蛋白由单克隆Ig(IgM、IgG或IgA)组成;Ⅱ型冷球蛋白血症中,冷球蛋白由单克隆Ig与多克隆Ig组成,具有类风湿因子活性;Ⅲ型冷球蛋白血症中,冷球蛋白由多克隆IgM和IgG组成。Ⅱ型和Ⅲ型冷球蛋白血症均可形成免疫复合物,因此统称混合型冷球蛋白血症。
冷球蛋白血症的分型与其病因诊断和治疗密切相关。Ⅰ型冷球蛋白血症通常与恶性血液疾病相关,如B细胞淋巴瘤、华氏巨球蛋白血症、多发性骨髓瘤等。Ⅱ型和Ⅲ型冷球蛋白血症主要与感染性疾病和系统性自身免疫疾病有关,常见病因包括慢性丙型肝炎病毒感染、系统性红斑狼疮、干燥综合征等。
冷球蛋白血症可累及多个器官,包括皮肤、关节、周围神经系统、肾脏等 。目前国际上尚无标准化的冷球蛋白血症的诊断标准,其诊断主要依靠血清冷球蛋白检测及典型的临床表现 。在世界范围内,已有多项研究对冷球蛋白血症患者的临床特征进行分析,但国内报道较少,原因可能是冷球蛋白测定对标本留取和实验室检测要求较高,所以开展冷球蛋白检测的临床实验室较少,另外医生对冷球蛋白认识不足,在出现累及多器官的系统性疾病时少有考虑冷球蛋白血症的存在。
近日新英格兰医学杂志发表综述“Cryoglobulinemia — One Name for Two Diseases”,阐述了冷球蛋白血症的主要病因、临床表现、诊断、病理生理学和治疗,将混合型和I型冷球蛋白血症视为两个不同亚型,各自具有独特的潜在机制、治疗方法和预后。现整理主要内容供参考。

本文要点
•冷球蛋白血症的病因目前仅限于少数血液系统疾病、系统性自身免疫性疾病和慢性感染。
•冷球蛋白血症临床综合征包括两种主要表型。
•I型冷球蛋白血症是一种真正的止血障碍,可导致多个中小型血管的机械阻塞(高黏血症,血栓形成,或两者兼而有之);患有这种疾病的患者有时会表现出血管炎症的迹象。
•II型和III型混合型冷球蛋白血症的特征为由补体介导的免疫复合物沉积引起的自身免疫性小血管炎。
•I型冷球蛋白血症通常由血液肿瘤引起,而混合型冷球蛋白血症的特征为B细胞惰性增生,最终可能导致明显的淋巴瘤转化。
•当需要药物治疗时,必须首先确定基础疾病,然后才能靶向B细胞谱系克隆。
机制
冷球蛋白血症有两种不同的潜在机制:I型冷球蛋白血症演变为影响中小型动脉的血管病变,而II型和III型混合型冷球蛋白血症表现为影响中小型血管的真正自身免疫性血管炎。在这两种类型中,来自B细胞谱系的淋巴细胞(如记忆B细胞或浆细胞)以单克隆或多克隆方式产生冷球蛋白。I型冷球蛋白是由浆细胞大量产生的单克隆IgM或IgG,形成紧密的大分子网,物理地将细胞困在血管内,这一过程称为rouleaux形成。因为I型冷球蛋白很少有类风湿因子活性,补体介导的炎症性血管炎较罕见。相反,I型冷球蛋白血症的主要机制涉及微循环内冷诱导聚集体的机械血管阻塞,导致小血管的微血栓形成。混合型冷球蛋白仅由多克隆免疫球蛋白(III型)或多克隆免疫球蛋白与单克隆IgM(II型)的组合组成,这种IgM通常具有类风湿因子活性,可激活免疫复合物内的补体,最终导致组织炎症和损伤。混合型冷球蛋白血症的另一个关键机制为淋巴细胞1型辅助性T细胞(Th1)和效应T细胞的扩张和组织浸润,它们产生促炎细胞因子,如肿瘤坏死因子α和干扰素-γ,以牺牲调节性T细胞为代价。

临床表现
临床表现方面,临床表现高度多样化,几乎可以影响任何器官,因此该综合征归类为真正的全身性疾病。大多数混合型冷球蛋白血症呈皮肤受累,皮肤受累的典型症状为血管性紫癜,呈典型的重力依赖性,从下肢开始,扩散到上肢,而不影响躯干和面部;反复发作可留下棕黄色皮炎的痕迹。皮肤受累也可能包括网状活斑、皮下结节、大疱、囊泡、冷性荨麻疹和手/脚趾感觉异常,而非真正的雷诺现象。在II型和III型混合型冷球蛋白血症中,皮肤受累的这些特征与体力劳动和直立性密切相关,而在I型冷球蛋白血症中,外部低温的作用极大。I型冷球蛋白血症的皮肤表现主要包括四肢灌注不足(如肢端坏死或雷诺现象),而混合型冷球蛋白血症主要表现为炎症性病变(如血管性紫癜或皮下结节)。临床上,I型冷球蛋白血症和混合型冷球蛋白血症的肾脏受累通常难以区分,可表现为肾性蛋白尿、动脉高血压、血尿、肾功能衰竭或这些特征的组合。I型冷球蛋白血症的肾脏受累可能与潜在的血液学状况有关(例如骨髓瘤相关肾脏疾病伴或不伴小管功能障碍)。混合型冷球蛋白血症患者最常见的神经功能损害为感觉-运动多神经病变,始于足部,很少延伸到膝盖以上;手也可能受累,但受累通常不影响手腕以上的上肢。感觉症状是典型的初始特征,在出现运动缺陷症状之前可持续数月甚至数年。突然发作的多发性单神经病变(不常见)可能类似于结节性动脉周围炎。大脑受累非常罕见,可能表现为局灶性缺陷或神经认知障碍。在I型冷球蛋白血症中,单克隆免疫球蛋白的大量存在可导致高黏血症症状,包括粘膜出血和神经感觉体征。广泛的临床表现包括视力模糊或减弱、复视、头痛、精神错乱、耳聋、眩晕、眼球震颤、共济失调、中风,甚至昏迷。

诊断
应明确冷球蛋白血症综合征的临床表现,但由于非常严格的采样要求,冷球蛋白的检测可能具有挑战性,研究证实9%的冷球蛋白血症患者最初的检测结果为假阴性。为了防止体外低温沉淀,分析前条件必须严格:血液样本必须保持在37°C,直到在实验室离心。低温沉淀在管状颗粒中表现为或多或少厚的边界,其数量以克/升或半定量测量(下图B)。免疫表型鉴定确定同种型的组成免疫球蛋白(I型、II型或III型分别约占10%、50%和40%),然后指导病因评估。血浆中低温纤维蛋白原(另一种冷蛋白)可能是I型冷球蛋白血症诊断检查中潜在的混杂因素,如果临床强烈怀疑冷球蛋白血症,但难以识别循环冷球蛋白,则可根据高病种球蛋白血症(可能伴有血清蛋白免疫固定的单克隆峰值)、补体消耗(低C4和CH50水平)和类风湿因子活性来怀疑其存在。此外,血清冷球蛋白的存在会干扰自动生物分析,导致假白细胞增多症、假巨细胞增多症,甚至矛盾的低丙种球蛋白血症(由于显著的免疫复合物沉淀)。应在基础诊断检查的基础上进行其他检查。在生物学诊断仍然难以捉摸的情况下,对目标组织(如皮肤、肾脏或周围神经)进行活检可提供确凿证据(下图C和D)。
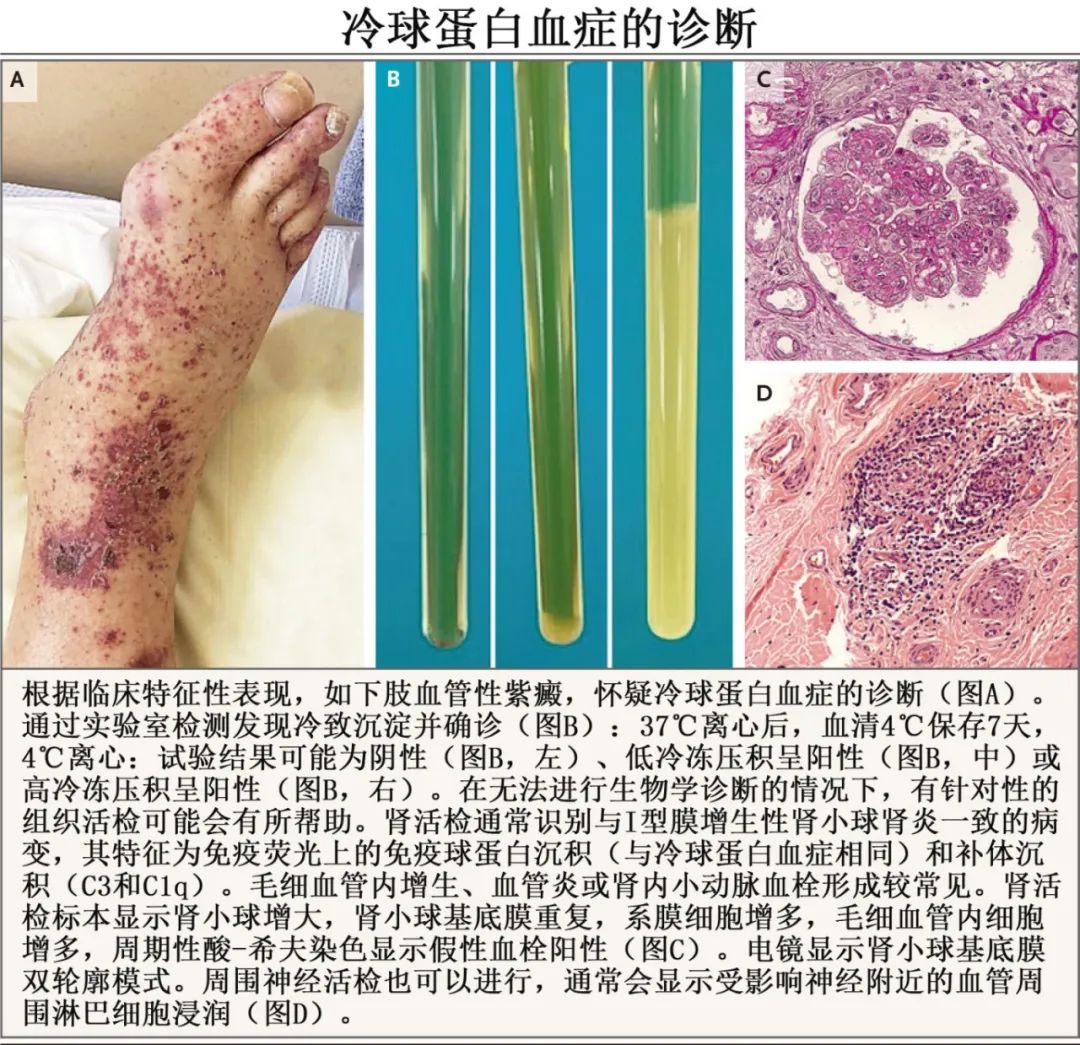
I型冷球蛋白血症的诊断检查通常包括全血细胞计数、蛋白电泳、血清蛋白免疫固定电泳、胸腹部CT扫描、PET断层扫描和骨髓活检。对于II型和III型混合型冷球蛋白血症,初始检查应包括病毒血清学检测(抗HCV抗体、HCV RNA、乙型肝炎表面抗原、抗乙型肝炎表面抗体、抗乙型肝炎核心抗体和抗HIV抗体);抗核抗体、抗可提取核抗原抗体和抗双链DNA抗体试验;如果可以的话,还要做唾液腺活检。此外,尽管血液肿瘤多与I型冷球蛋白血症相关,但也可能导致II型冷球蛋白血症,因此在诊断检测时应考虑针对II型冷球蛋白血症的特异性检查。


治疗
出现症状的冷球蛋白血症患者应进行评估以确定治疗方法,并特别考虑基础病因。对于I型冷球蛋白血症患者来说,避免低温暴露是必要措施,而压力袜对于只有紫癜的患者来说可能足够。糖皮质激素和血浆交换是有药物治疗指征的患者的一线策略。应与血液学家密切合作,在潜在血液疾病缺乏治疗指征的情况下,应根据疾病同型确定I型冷球蛋白血症的治疗。利妥昔单抗、烷化剂和BTK抑制剂是治疗IgM介导的疾病的首选药物,而硼替佐米、抗CD38药物(如isatuximab和达雷妥尤单抗)和免疫调节剂(如来那度胺和沙利度胺)已被用于治疗IgG 介导的疾病。对于II型和III型混合型冷球蛋白血症,治疗方案应根据血管炎的严重程度来选择,当病因是传染性的时候,包括根除病毒触发因素。对于HCV相关混合型冷球蛋白血症,直接抗病毒药物通常足以实现持续的病毒学应答和轻至中度疾病的血管炎缓解。可能处方短期、低剂量的糖皮质激素治疗(即每天≤0.5mg/Kg),但大多数患者可通过无糖皮质激素方案恢复。对于重度疾病,直接抗病毒药物应联合利妥昔单抗(在第1、8、15和22天,375mg/m2)。在危及生命的情况下(如肾小球肾炎伴肾功能受损、运动障碍、多发性单神经病变、广泛皮肤坏死,或累及消化道、心脏或肺部),直接抗病毒药物应联合大剂量糖皮质激素(即0.5-1.0g甲强龙,连续3天,随后逐渐减少口服糖皮质激素剂量)和血浆交换。在罕见合并血液肿瘤的情况下,联合利妥昔单抗、氟达拉滨、环磷酰胺已成功在有经验的中心使用。对于对直接抗病毒药物无反应或有禁忌症的患者,可以单独使用利妥昔单抗进行诱导,然后每6至9个月输注500mg作为维持治疗。非感染性混合型冷球蛋白血症可通过使用针对潜在病因的现有治疗手段(例如秋水仙碱或甲氨蝶呤)进一步得到控制。

参考文献
Cacoub P,et al.Cryoglobulinemia — One Name for Two Diseases.N Engl J Med . 2024 Oct 17;391(15):1426-1439. doi: 10.1056/NEJMra2400092.


