【AJH】AML的MRD检测手段及对治疗决策和新药开发的影响
时间:2024-10-20 06:02:40 热度:37.1℃ 作者:网络
AML的MRD检测
可测量残留病(MRD)与急性髓性白血病(AML)患者的复发风险和长期生存结局密切相关,除了其明确的预后影响外,MRD信息也越来越多地用于指导治疗决策,包括选择合适的干细胞移植患者、移植后维持治疗的使用及非移植维持治疗或MRD指导的临床试验。虽然在准确评估MRD和了解其临床重要性方面取得了巨大进展,但关于如何优化MRD检测和指导个体患者的治疗决策,目前仍存在许多问题。
MD安德森Nicholas J. Short教授和伦敦国王学院/盖伊和圣托马斯医院Richard Dillon教授近日于《American Journal of Hematology》发表综述,讨论了评估AML MRD的常用方法以及MRD在常见临床情况下对预后的影响,还回顾了MRD的新兴和试验性策略,并讨论了该领域一些重要的未解问题和挑战。

前言
过去十年在检测AML患者亚显微水平疾病的技术发展方面取得了重大进展,其中在临床缓解期检测MRD显著改善了风险分层,并越来越多地用于选择或改进缓解后治疗。将MRD纳入治疗策略有望增加个性化治疗以改善预后。然而AML是一种高度异质性的疾病,包括几种不同的生物亚型,因此与其他很多血液系统恶性肿瘤相比,还没有单一的最佳MRD检测可以适用于所有AML患者。此外,对于不同的分子学亚型和治疗方案,不同时间点MRD的临床意义也存在差异,因此基于MRD的干预措施也有所不同(表1)。
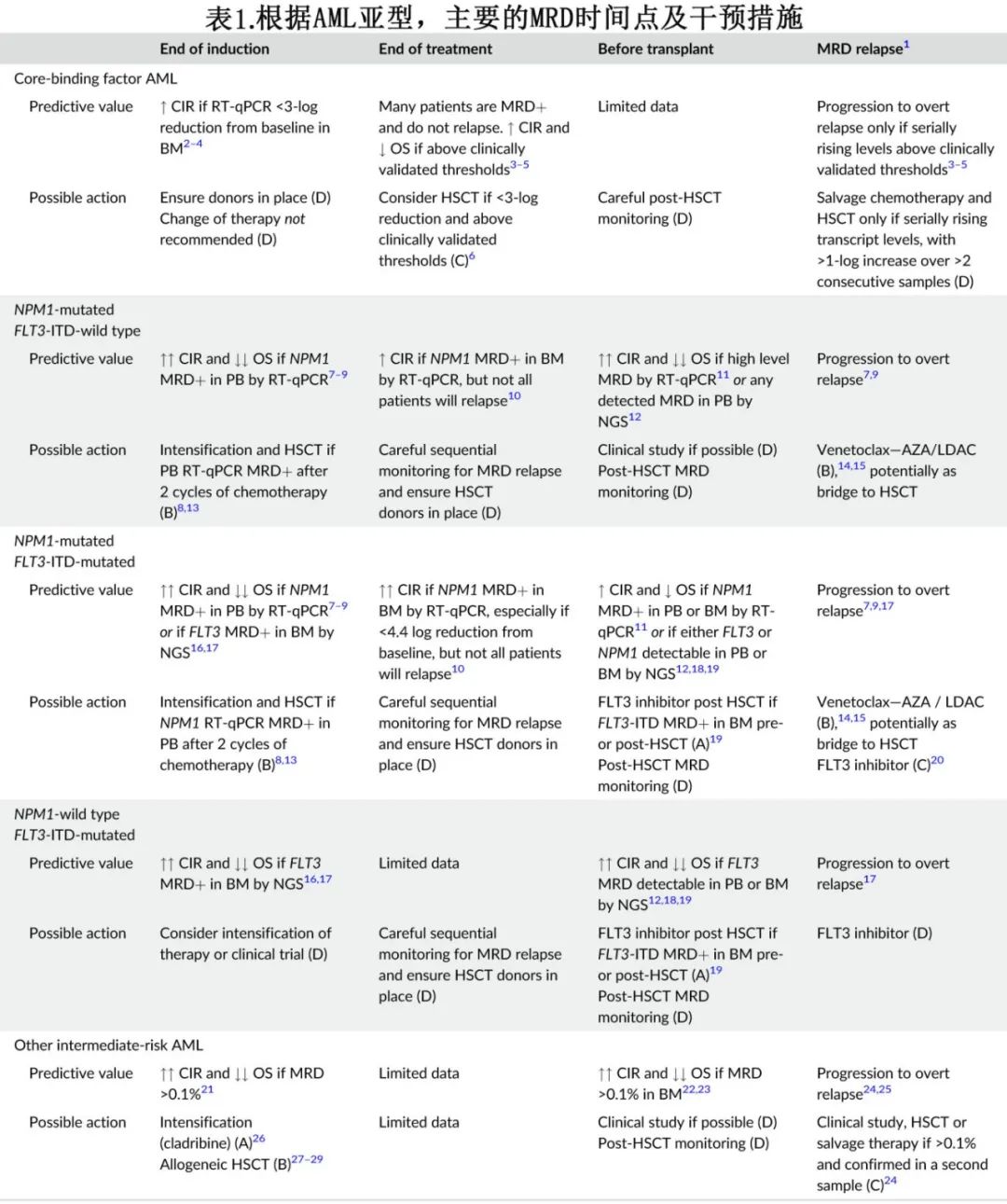
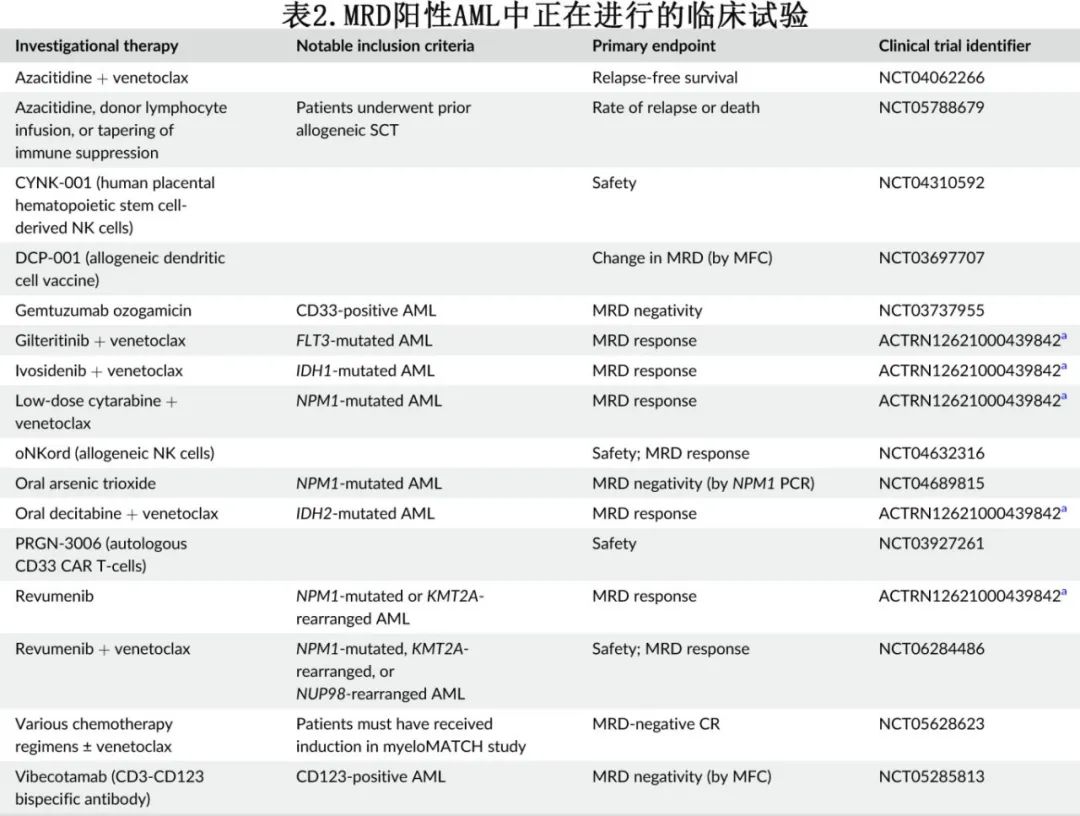
作者目标是澄清与AML中使用MRD相关的关键问题,使临床医生能够自信地使用这些技术来造福患者。作者还讨论了旨在靶向和根除AML患者MRD的正在探索的新策略(表2)。
AML中的MRD检测方法
多参数流式细胞术
多参数流式细胞术(MFC)通常用于评估没有可靠分子MRD标志物的患者的MRD。使用MFC, MRD可以根据白血病相关免疫表型或“different from normal”的方法来识别,但更建议将两种方法结合使用。在大多数临床实验室中,在足够的细胞输入的情况下,MFC可以达到0.1%-0.01%的灵敏度(即1000至10000个有核细胞中有1个白血病细胞)。评估白血病干细胞标志物(如CLL1、CD45RA、CD123、CD200和其他)可提高检测的灵敏度,并提供额外的预后信息。在共识指南中,MFC MRD阳性定义为≥0.1%水平的可检测MRD,因该cutoff值已在大型临床研究中得到验证。但也有回顾性分析表明MRD水平<0.1%也具有预后重要性,较低的cutoff值可提供额外的辨别能力。
MFC的一个主要优势在于它几乎适用于所有AML病例,因其依赖于白血病原始细胞的抗原表达,而非特定的分子特征。MFC的速度也很快(在高通量实验室只需1~ 2天的周转时间),且相对便宜。然而MFC的使用也存在挑战,因其很难标准化,并且对MRD的准确评估需要大量的专业知识,导致MRD结果在实验室之间可能存在差异。部分AML病例的免疫表型特征性相对较低,导致准确识别MRD并将其与正常造血区分开来存在一定困难。几乎所有基于MFC的MRD研究都评估骨髓(BM)样本,导致其便利性不如已在外周血(PB)中得到充分验证的分子学MRD检测方法。小型研究表明PB MFC MRD可能有用,但与BM相比灵敏度降低;还需要进一步验证。
聚合酶链反应
MRD检测的分子学方法利用白血病特异性基因组异常,包括染色体重排和体细胞突变。重排可产生融合转录本,RUNX1::RUNX1T1、CBFB::MYH11和KMT2A重排等可以很容易通过RNA的逆转录(RT)和定量PCR(qPCR)进行检测。RNA是必需的,因为融合断点在基因组中广泛分布,通常在内含子区域,但产生的融合转录本数量有限。常见融合转录本(如CBFB::MYH11和RUNX1::RUNX1T1)的RT-PCR检测已标准化,具有高特异性和敏感性(通常为1x10-5 [0.001%]或更高)。RT-qPCR也广泛用于检测NPM1突变,由于这些是≥4个碱基对的插入,RT-PCR可以高特异性地检测突变转录本,而它们的高表达水平提供了高灵敏度(高达1 x10-6 [0.0001%])。基于DNA的qPCR也是可行的,但灵敏度较低。灵敏度还取决于输入的RNA/DNA的数量,因此足够的样品质量必不可少。
基于PCR的方法对其他体细胞突变的效用有限。它存在的其他限制包括相对较长的周转时间、对快速样品运输的要求(以防止RNA降解)、对罕见融合转录本和NPM1突变序列进行标准化检测存在困难,以及防止假阳性和假阴性结果需要严格对照;实验室间质控系统是防止假阳性和假阴性的重要措施。RT-qPCR可以应用于PB或BM样品,但BM的灵敏度通常高大约10倍,因此PB和BM的MRD检测可能具有不同的预后意义。
二代测序
二代测序(NGS)原则上可用于检测任何体细胞突变,但目前常用测序方法的灵敏度受到常用测序方法背景错误率的限制。目前大多数技术依赖于单个或小组基因的PCR扩增,DNA聚合酶引入的错误可能进一步限制灵敏度。大多数靶向NGS panel 对大多数临床有意义突变的敏感性为约1-2%。提高灵敏度的技术包括结合独特的分子标识符寡核苷酸(UMI)和标记两个DNA链(双工测序),允许后来的生物信息学去除PCR或测序错误。错误率因突变类型和周围序列环境而异。因此,尽管对于插入缺失(InDel)突变(如NPM112和FLT3.41)的灵敏度可以提高10到100倍,但保守的阈值为0.1% 。除了这些技术限制外,常规采用NGS MRD技术的主要生物学障碍在于许多白血病相关突变在完全缓解(CR)中持续存在,表明逆转为临床意义未定的克隆性造血(CH)。值得注意的是,NGS对AML中持续性突变的解释可以通过排除与CH最常见的基因突变(例如DMT3A、TET2和ASXL1 -“DTA”突变)来部分解决。在排除DTA突变后,AML中分子MRD的持续存在与显著较高的复发率相关。NGS MRD技术已应用于PB和BM,但还没有进行详细的比较。此外还没有比较RT-qPCR和NGS检测NPM1 MRD的可靠数据,而大多数可以为治疗决策提供信息的临床研究都使用RT-qPCR。NGS检测的低灵敏度可能无法检测出部分高危患者和早期MRD复发的患者。
MRD对AML的预后影响
持续或复发性MRD与AML患者的不良预后相关。MRD与生存结局的关联在81份出版物的大型荟萃分析中得到了一致的结果,其中包括11151例患者。MRD阴性患者的5年无病生存率为64%,而MRD阳性患者为25%;5年总生存率(OS)分别为68%和34%。MRD的明显影响在不同年龄、MRD时间点、AML亚型、标本来源和大多数MRD方法上都可以证实。另一项荟萃分析显示,无论血液学反应或MRD阈值如何,MRD的影响均一致。下文介绍支持MRD在特定临床情况下具有预后影响的部分研究。
基于MFC的MRD
基于MFC的MRD在AML治疗中具有高度预后价值。英国国家癌症研究所(NCRI) AML17研究纳入接受一线治疗的年轻成人AML患者,对于在第一个诱导周期后实现CR伴血液学不完全恢复并存在持续MRD的非高危AML患者,其5年OS与仅实现部分缓解的患者相似。在标危NPM1野生型AML患者中,第2周期后持续MRD≥0.1%的患者累积复发发生率(CIR)为89%,5年OS为33% (MRD阴性患者为63%)。值得注意的是,MRD阴性通常在基线细胞分子学特征更良好的患者中富集,也反映出这些亚型的化疗敏感性。例如,基线CEBPA、NRAS、KRAS和NPM1突变可预测诱导化疗后MRD阴性率高,而TP53、SF3B1、ASXL1和RUNX1突变可预测MRD阴性率低。
其他几项研究也证实了MRD在诱导、巩固和巩固结束时持续存在的负面影响。移植前基于MFC的MRD也具有预后作用,一项研究表明,MRD阳性缓解时异基因干细胞移植(HSCT)的患者与HSCT时活动性疾病患者的结局相似。HSCT前MRD的影响在19项研究的荟萃分析中得到证实(其中11项研究评估MFC MRD),其中HSCT前MFC MRD阳性与1.98的死亡风险比相关。
很多研究已评估持续MRD对接受一线AML治疗或围移植期患者的影响,但基于MFC的MRD在复发/难治性情况下也具有预后作用,与较高的复发率和较差的无复发生存期(RFS)独立相关。MRD初始转阴后复发的患者预后也特别差,是即将复发的征兆。在一项分析中,MFC MRD复发的5年RFS率为6%、OS率为22%。在MRD复发时进行干预,包括改变化疗方案和/或异基因HSCT与结局改善相关(5年OS为45%,未干预为17%;P=0.01),提示密切相关监测基于MFC的MRD具有预后和治疗意义。
特定基因组亚群的分子学MRD
NPM1突变AML
诱导化疗后通过RT-qPCR检测NPM1 MRD对复发和死亡都有很强的预后作用。德国AML研究组(AMLSG)显示,第二周期诱导后BM检测到NPM1 MRD的患者4年OS为51%,而阴性患者为90%。在法国急性白血病协会(ALFA) 0702研究中,诱导后PB NPM1 MRD未达到≥4 log降低的患者的4年OS为41%,而阴性患者为92%。NCRI AML17研究报告,经过两个周期治疗后PB NPM1 MRD阳性患者的4年OS为24%,而阴性患者为73%。
巩固治疗结束时的MRD更难解释,因为治疗后稳定、低水平MRD的部分患者从未复发。在一项研究中,强化疗后BM MRD阳性患者中42%自发转化为MRD阴性或具有稳定的低水平MRD且未复发。
对于接受移植的患者,RT-qPCR或NGS检测NPM1 MRD对预后有很强的预测作用。在NCRI AML17研究中,对于PB NPM1 MRD水平>200拷贝/105 ABL或BM >1000拷贝,或具有任何MRD水平伴基线FLT3内部串联重复(ITD)的患者,其2年OS为18%,而低于这些阈值的患者为82%。在国际血液和骨髓移植研究中心(CIBMTR) Pre-Measure研究中,使用NGS在移植前血液中检测到NPM1 MRD的患者的3年OS为35%,而阴性患者为66%。
治疗后,检测BM或PB中连续升高的MRD水平可以可靠地预测复发。因此目前的指南将下列情况定义为MRD复发:MRD阴性转化为MRD阳性,或MRD增加>1-log(两种情况均需重复采样检测)。
核心结合因子AML
诱导化疗后通过RT-qPCR检测到CBFB::MYH11或RUNX1::RUNX1T1转录本可预测复发,但在大多数研究中无法预测生存。在法国CBF-2006研究中,两个周期后MRD(BM)降低<3 log的患者2年CIR为54%,而MRD反应较好的患者为22%。而一项AMLSG研究使用相同阈值,CIR为51% vs 28%。但在两项研究中MRD都不是OS的预后因素。然而在MD安德森癌症中心的一项研究中,诱导后BM PCR值<0.1%的核心结合因子(CBF) AML患者的OS优于MRD值较高的患者(5年OS分别为85%和61%;P=0.01)。这些研究结果不同的原因尚不清楚,但应注意的是MD安德森研究使用更强烈的诱导方案(FLAG-Ida或FLAG-GO)。
治疗结束时CBF AML PCR检测到融合是复发和OS的预后,但也有相当一部分MRD阳性患者永远不会复发。在AMLSG研究中,治疗结束时约半数患者BM RUNX1::RUNX1T1呈MRD阳性,4年CIR为36%,而MRD阴性者为17%;四分之一的患者为PB MRD阳性,其4年CIR为55%,MRD阴性患者为23%。较高的cutoff值可识别较高的复发风险患者。持续性MRD的高患病率也为随访期间MRD的解释提出挑战。在AMLSG研究中,从MRD阴性转化为MRD阳性的患者中只有24%最终复发,其余患者要么持续低水平MRD,要么自发转化为MRD阴性。PB阈值50拷贝/106 B2M和BM阈值150拷贝可以更好地识别有复发风险的患者,分别为84%和77%。英国NCRI AML15研究也报道了类似的发现,对于治疗结束或随访期间BM RUNX1::RUNX1T1转录水平>500拷贝/105 ABL或PB >100拷贝的患者,复发率为100% vs 7%;对于BM CBFB::MYH11转录水平>50拷贝/105和PB ABL >10拷贝的患者,复发率分别为100% vs 10%和97% vs 7%。MRD水平连续升高的患者普遍会复发。
总体而言,对于CBF-AML患者,在频繁MRD阳性且临床意义不确定的背景下,必须特别注意避免将患者标记为MRD失败,除非其MRD高于临床验证的阈值或MRD水平连续上升。
FLT3突变AML
通过NGS进行灵敏的FLT3-ITD检测直到最近才实现,但其预测影响是惊人的。在荷兰成人血液肿瘤基金会(HOVON)的一项研究中,经过两个周期的强化疗后,BM FLT3-ITD MRD阳性患者的4年OS为31%,而阴性患者为57%。在AMLSG 1610研究中,2个化疗周期后的4年OS分别为70%和42%。此外在这两项研究中,对于同时存在FLT3-ITD和NPM1突变的患者,FLT3-ITD MRD可提供额外的预后信息。在QUANTUM-First研究中,诱导后BM中FLT3-ITD MRD <10-4的新诊断AML患者的预后优于MRD≥10-4的患者(中位OS未达到vs 29.4个月;HR=0.562)。在CIBMTR Pre-Measure研究中,移植前PB中可检测到FLT3-ITD MRD的患者的3年OS为31%,而MRD阴性的患者为63%。在NCRI AML17研究中,移植前BM或PB FLT3-ITD MRD阳性的患者3年OS为26%,而阴性患者为74%。随访期间FLT3-ITD MRD的数据很少,但在AMLSG研究中,BM中检测到MRD到复发的中位时间<1个月,表明连续监测可能不太有用。
低强度治疗中MRD的影响
从历史上看,低强度治疗的预后非常差,因此MRD几乎没有意义,但随着新型非强化治疗的引入,老年患者的前景发生了重大变化,导致对这种情况下MRD的重新关注。可参考【AJH】AML低强度治疗中的MRD监测建议:ELN-DAVID专家小组路径。在VIALE-A研究中,在阿扎胞苷+维奈克拉治疗期间任何时间通过MFC达到MRD阴性的患者,其2年OS为78%,而MRD阳性患者为40%。在另一项针对新诊断老年AML患者的地西他滨+维奈克拉的前瞻性研究中也报道了类似的数据,在治疗开始后2个月内MFC MRD阴性的中位OS为25.1个月,而在此时间点MRD阳性的患者仅为7.1个月。最近的一项回顾性研究检查了采用维奈克拉为基础的非强化疗法治疗的NPM1突变AML患者的结果,这些患者通过RT-qPCR评估MRD;在第4周期结束时,47%的BM患者达到MRD阴性,2年OS为84%,而MRD阳性患者为46%。有趣的是,在22例MRD阴性并停止治疗的患者中只有2例复发。对于接受现代非强化方案治疗的患者,还需要对分子学和流式MRD进行进一步的前瞻性研究。
MRD指导干细胞移植决策
中危AML中基于MFC的MRD
基于MFC的MRD可能会影响首次缓解期异基因HSCT巩固的决策,特别是对于中危AML患者,该群体在最佳巩固策略方面争议最大。然而相关数据较为混杂,部分原因在于使用不同的患者人群和风险分层方法。在NCRI AML17研究中治疗的标危NPM1野生型AML患者中,两个化疗周期后MFC MRD与异基因HSCT获益之间可能存在相互作用。虽然可能由于数量少而没有统计学意义(p=0.16),但该分析表明,实现MRD阴性的患者倾向于从化疗巩固中获益,而持续性MRD患者倾向于从HSCT中获益。但在另一项纳入中危AML的年轻成人的研究中,MFC MRD阴性患者在化疗巩固、自体HSCT和异基因HSCT之间的结局相似。 对于MRD清除缓慢、MRD持续或MRD复发的患者,异基因HSCT有更好的结局。GIMEMA AML1310研究前瞻性地将中危AML且持续MRD阳性(通过MFC或适当的分子标志物)的患者分配接受异基因HSCT,而MRD阴性患者则接受自体HSCT,结果2年OS无差异(79% vs 70%,p=0.72),表明使用MRD来指导异基因HSCT可以克服MRD阳性对预后的负面影响。
NPM1突变AML
在ALFA0702研究中,在PB MRD降低<4-log的患者中观察到HSCT的显著OS获益,而在其他患者中则没有,表明NPM1 MRD可在选择移植患者时发挥作用。NCRI AML17/19研究的荟萃分析进一步支持该概念:第2周期后PB MRD阳性患者可获益于首次缓解期HSCT (HR=0.39),而PB MRD阴性患者没有获益(HR=0.82)。此外,对于基线FLT3-ITD和/或DNMT3A共突变的PB MRD阴性患者,HSCT没有OS获益,表明在选择首次缓解期可能获益于HSCT的患者时,MRD可能超过基线因素。
核心结合因子AML
在中国AML05研究中,在3-4个化疗周期后,BM中RUNX1::RUNX1T1转录本未能达到≥3-log降低的患者接受异基因HSCT,并似乎从中受益(4年OS为72%,而MRD水平较高的患者为27%);而在MRD降低≥3-log的患者中未观察到HSCT的获益,其中未进行HSCT的4年OS为100%。
FLT3突变AML和其他分子标志物
对于没有NPM1突变的FLT3-ITD患者,以及被欧洲白血病网络(ELN)指定为高危的基因融合患者,HSCT是根治性治疗的重要组成部分。目前,MRD在指导这些患者的移植决策方面还没有确定的作用,还需要更大规模的研究来评估高灵敏度FLT3-ITD MRD检测对预后及HSCT决策的影响。对于ELN中危组的融合基因患者(例如KMT2A:: MLLT3、NPM1::MLF1),目前缺乏关于MRD作用的可靠数据,但可能在其他因素的基础上影响HSCT决策。
MRD对预处理强度的潜在影响
在首次缓解期接受异基因HSCT的患者中,MRD状态可能会影响HSCT前预处理方案。在一项研究中,MFC HSCT前MRD患者使用清髓性预处理(MAC)方案比使用减低强度预处理(RIC)方案更有可能清除MRD (MRD清除率分别为82%和58%;P=0.002);然而使用MAC方案从MRD阳性转化为阴性的患者预后仍较差,仅略好于未转化的患者(3年OS率分别为35%和21%)。在另一项研究中,预处理强度对结局没有影响,无论预处理强度如何,HSCT前MRD阳性患者的结果均很差(MAC组3年CIR为63%,RIC组为57%)。在EBMT一项2292例患者的大型研究中却观察到相反结果,相对于MAC,接受RIC或非清髓性预处理的年龄小于50岁且可检测到HSCT前MRD的患者无白血病生存率较低、复发风险较高;对年龄小于50岁且未检测到MRD的患者或年龄≥50岁的患者(无论MRD状态如何),预处理强度似乎对生存率没有显著影响。另一项研究评估了预处理强度对HSCT前MRD的AML患者的影响,使用13个常见突变基因的超深度、错误校正测序进行评估;在排除潜能未定CH (CHIP)相关突变(例如DNMT3A、TET2和ASXL1)后,预处理强度对HSCT前未检测到MRD的患者的OS没有影响(3年OS:MAC患者为56%,RIC患者为63%)。相比之下,对于HSCT前MRD阳性的患者,MAC的预后优于RIC (3年OS分别为59%和34%;P=0.01)。这些数据表明,HSCT前分子MRD可用于合理告知接受异基因HSCT的AML患者的最佳预处理强度,特别是对于HSCT前MRD阳性患者。虽然关于HSCT前MRD对选择预处理方案强度的影响存在相互矛盾的数据,但应注意的是,ELN指南建议,在可行的情况下对HSCT前MRD患者进行MAC治疗。
MRD指导移植后维持治疗
由于HSCT前后可检测到FLT3 MRD的患者预后较差,因此可以使用FLT3抑制剂。该方案得到MORPHO研究数据的支持,在该研究中,使用基于PCR的NGS检测FLT3-ITD MRD阳性的患者显示吉瑞替尼维持具有RFS获益(HR=0.51)和OS获益的趋势,尽管MRD阴性患者没有获益。MRD在指导其他AML亚型移植后维持治疗中的作用仍在探索。
MRD指导非移植治疗
虽然HSCT对于MRD阳性AML患者来说是一种潜在的确定性和治愈性手段,但在这种情况下,HSCT的结局仍然不理想。由于年龄或合并症,许多患者也不适合HSCT。正在进行的临床试验评估了清除AML患者MRD的新药物和新方法,见表2。
去甲基化药物
去甲基化药物(HMA)作为AML的单药治疗有效,并且可能在持续性或复发性AML患者中发挥作用。在RELAZA2研究中,53例化疗或HSCT后的CR患者接受阿扎胞苷治疗MRD阳性复发;19例者(36%)转为MRD阴性,MRD反应与改善RFS (p<0.001)和改善OS的势相关。随机数据现在也支持将HMA用于不适合HSCT的缓解期AML患者,包括持续性或复发性MRD阳性患者。在QUAZAR AML-001研究中,≥55岁、在强化疗后获得缓解且不适合HSCT的成年患者随机分为口服阿扎胞苷组和安慰剂组,口服阿扎胞苷可改善生存(中位OS: 24.7个月vs安慰剂14.8个月;p<0.0001)。随后的分析显示,优越结果可能部分是由于口服阿扎胞苷组的MRD清除率更高(37% vs 安慰剂组19%;比值比2.50)。无论MRD状态如何,口服阿扎胞苷都有获益,且在入组时MRD阳性的患者中,实现MRD阴性与较长的OS相关(MRD缓解的中位OS为41.3个月,而持续MRD阳性为9.0个月;风险比0.21)。
靶向治疗
随着针对分子学定义的AML亚群的有效靶向药物的发展,这些药物正在探索用于MRD阳性患者,一些小型研究表明靶向治疗具有潜在获益。在一项回顾性分析中,56例分子学复发的FLT3突变患者接受FLT3抑制剂单药治疗,60%的患者达到分子学缓解(定义为分子MRD靶点降低≥1 log10),45%的患者达到MRD阴性;2年OS率为80%,分子学无事件生存率为56%,优于该人群的历史预期。低剂量维奈克拉为基础的方案治疗NPM1突变AML也是治疗该亚群AML的一种很有前途的方法。在一项回顾性研究中,79例NPM1突变AML患者接受阿扎胞苷或低剂量阿糖胞苷(LDAC)联合维奈克拉治疗MRD复发、持续或进展,结果56例(71%)患者达到MRD阴性,且基线无FLT3-ITD的患者中更高(79% vs FLT3突变患者50%);总体患者2年OS为67%,而基线无FLT3-ITD突变的患者为78%。一项前瞻性研究中,低剂量阿糖胞苷(LDAC)联合维奈克拉治疗原始细胞<15%的复发性AML,纳入26例MRD复发患者,其中20例有NPM1突变;54%的患者达到MRD阴性,2年OS为67%。进一步的前瞻性研究也计划在MRD阳性AML中评估类似的分子靶向策略。例如,正在进行的澳大利亚白血病和淋巴瘤组(AALG) AMLM26 INTERCEPT研究是一项多臂临床试验,将持续性或复发性MRD阳性AML患者分配接受靶向药物联合治疗,包括:吉瑞替尼+维奈克拉治疗FLT3突变AML,艾伏尼布+维奈克拉治疗IDH1突变AML,口服地西他滨+维奈克拉治疗IDH2突变的AML, revumenib治疗KMT2A重排AML,以及低剂量阿糖胞苷+维奈克拉或revumenib治疗NPM1突变AML。
免疫疗法
对种免疫疗法已经在MRD阳性AML的治疗中进行前瞻性评估。虽然许多基于免疫治疗的试验性药物在复发或难治性AML中的反应率相对较低,但在低原始细胞状态下评估这些药物的兴趣可能更大,因为这些药物可能更有活性。在其他血液系统恶性肿瘤(如急性淋巴细胞白血病[ALL])的免疫治疗中也观察到这种关联,其中CD3-CD19双特异性抗体贝林妥欧单抗在MRD阳性ALL中获得的缓解率明显高于显著复发或难治性疾病。同样,vibecotamab是一种CD3-CD123双特异性抗体,在接受目标剂量治疗的复发/难治性AML成人患者中,总缓解率为12%,但有趣的是,在BM或PB原始细胞<25%的患者中均观察到应答,表明药物疗效与疾病负荷之间存在关系。目前正在对MRD阳性AML (MFC≥0.1%)患者进行随访研究。在15例MRD阳性AML患者中,4例患者(27%)达到MRD阴性(<0.01%),其中3例患者在末次随访时持续MRD阴性缓解。FLYSYN(一种fc优化的FLT3单克隆抗体)也观察到令人鼓舞的数据。在一项I期研究中,31例持续或增加性MRD(基于PCR或NGS)患者接受治疗;11例患者(35%)达到分子血缓解(定义为1-log MRD减少或MRD阴性),其中6例患者(19%)达到MRD阴性。其他几种基于免疫的药物也观察到MRD反应,包括CYNK-001 (CD56+/CD3-富集的异基因NK细胞)和DCP-001(白血病来源的树突状细胞疫苗)等。
面临的挑战和未来方向
MRD在AML的临床环境中具有高度预后作用,是对患者进行风险分层和预测长期结局的重要早期治疗终点,也可能有助于治疗决策,包括使用异基因HSCT或MRD导向临床试验的资格。然而,构成最佳“MRD阴性”反应的因素包括疾病、方案和检测相关因素,这使得开发跨机构MRD指导的治疗策略极具挑战性。虽然ELN在开发标准化MRD分析和实践方面的协调努力是朝着AML MRD更统一的诊断方法迈出的有益一步,但其中许多建议很难应用于其他临床环境,这些临床环境可能无法获得推荐的检测和/或可能使用不同的技术校准。AML新型一线治疗的发展也可能改变持续MRD的历史预后和治疗意义。例如,在传统7+3化疗背景下制定的异基因HSCT的MRD指导性适应症,在使用一线强化或低强度维奈克拉方案时可能不一定适用,且这在临床实践中越来越普遍。同样,构成“中危”AML (MRD最有可能影响异基因HSCT决策的群体)的定义中细胞遗传学和分子特征不断变化,导致对这一人群维持良好验证的和最新的推荐具有挑战性。
MRD也可能在AML药物开发中发挥越来越关键的作用。鉴于MRD阴性与更好结局的一致性和强相关性,导致出现一个问题,那就是MRD是否可以作为早期反应终点以更快地评估新疗法的疗效,并加速批准MRD阴性CR率高的有希望的药物。美国食品和药物管理局(FDA)已经为MRD作为血液恶性肿瘤(如AML)的替代终点提供指导,MRD终点已用于ALL药物的批准,如贝林妥欧单抗用于MRD阳性B细胞ALL,或ponatinib用于新诊断费城染色体阳性ALL。FDA肿瘤药物咨询委员会(ODAC)最近也一致投票支持在多发性骨髓瘤临床试验中使用MRD作为加速审批终点。然而MRD作为AML的替代终点尚未被广泛接受。虽然MRD阴性的预后价值在数十项研究中都是可靠的,但FDA要求前瞻性临床试验的数据证明MRD与生存率的变化相关。然而目前此类数据相对较少,因此需要将MRD状态作为未来AML新药和新方案的随机研究的关键终点。理想情况下,这些研究还应纳入标准化的MRD分析,以便在临床试验中使用和比较。
对AML生物学的更深入了解导致了多个有前途的MRD导向临床试验的发展,但这些试验性方法获得监管机构批准的路径仍未明确。目前还没有AML药物基于MRD转换率获得批准,虽然从MRD阳性状态到MRD阴性状态的转换应该会导致更好的生存结果,但这种关联也必须在使用可接受的、标准化MRD终点的前瞻性研究中显示。基于贝林妥欧单抗治疗MRD阳性B细胞ALL 的经验,或许对于MRD应答者,高MRD阴性率和明显的生存获益就足以基于单臂研究获得监管部门批准。否则的话,就需要开展随机研究,在MRD阳性AML患者中比较试验性MRD导向治疗与医生选择的治疗。
参考文献
Short NJ, Dillon R.Measurable residual disease monitoring in AML: Prospects for therapeutic decision-making and new drug development.Am J Hematol . 2024 Sep 25. doi: 10.1002/ajh.27482.


