Nature Biotechnology:耐热性GeoCas9与LNP的结合:高效递送与低脱靶风险的体内基因编辑新策略
时间:2024-10-20 15:02:33 热度:37.1℃ 作者:网络
引言
随着基因编辑技术的不断进步,CRISPR-Cas9系统因其高效、简便和特异性强,成为了近年来最受关注的基因编辑工具之一。CRISPR-Cas9系统依赖于Cas9蛋白与向导RNA (sgRNA) 的协同作用,可以精确地在基因组中特定位点引入双链断裂,并通过细胞自身的修复机制进行基因编辑。该系统在遗传疾病治疗、癌症研究及农业改良等方面展现出巨大的应用潜力。然而,如何安全、有效地将CRISPR-Cas9递送至目标细胞或组织,一直是基因编辑领域亟待解决的问题。
目前,病毒载体是体内递送CRISPR基因编辑工具的主要手段,尤其是腺相关病毒(AAV)载体。然而,病毒载体递送面临一系列挑战,包括免疫反应、基因组插入的潜在风险以及由于编辑工具持续表达导致的脱靶效应。为了解决这些问题,非病毒递送策略应运而生,特别是脂质纳米颗粒(Lipid Nanoparticle, LNP)作为一种非病毒递送工具,因其低免疫原性、可控的递送效率以及在临床应用中的安全性而备受关注。LNP被成功应用于肝脏基因编辑,但其在其他器官的递送效果仍不尽如人意。
在基因编辑领域,利用脂质纳米颗粒(LNP)传递稳定的CRISPR-Cas9核糖核蛋白(Ribonucleoprotein, RNP)正在成为一种高效、低毒且可扩展的体内基因编辑手段。10月16日Nature Biotechnology的研究报道“Lung and liver editing by lipid nanoparticle delivery of a stable CRISPR–Cas9 ribonucleoprotein”通过对源自地芽孢杆菌(Geobacillus stearothermophilus)的耐热性Cas9 (GeoCas9)进行工程化改造,成功设计出改进版GeoCas9 (iGeoCas9),其基因编辑效率比原始GeoCas9高出百倍以上。利用iGeoCas9 RNP与LNP形成的复合物,团队实现了对多种细胞类型的基因编辑,并在同时递送单链DNA模板时诱导同源重组修复(Homology-Directed Repair, HDR)。通过组织选择性LNP配方,研究人员在小鼠肝脏和肺部实现了16%至37%的基因编辑效率。这一成果表明,耐热性Cas9 RNP-LNP复合物在体内基因编辑中的治疗潜力大大提高。
该研究的重要进展在于通过定向进化方法改造GeoCas9,以增强其编辑效率并扩大其PAM (Protospacer Adjacent Motif) 序列的兼容性。改进后的GeoCas9(iGeoCas9)在小鼠神经前体细胞和人类胚胎肾细胞中显示出显著的基因编辑能力,且对脱靶效应的检测结果非常低。这些研究为CRISPR基因编辑的临床应用提供了新的可能性,尤其是在涉及多种细胞和器官的体内编辑方面。通过该研究,GeoCas9 RNP与LNP的结合展现出广泛的应用前景,为遗传疾病的治疗提供了一种新的、有效且安全的基因编辑工具。

随着基因编辑技术的迅猛发展,CRISPR-Cas9系统因其高效、便捷和高度特异性,已经成为最具前景的基因编辑工具之一。CRISPR-Cas9系统通过Cas9核酸酶与单导向RNA(single guide RNA, sgRNA)的协同作用,在基因组的特定位点引入双链断裂,随后通过细胞内的修复机制实现精确的基因组编辑。该系统在遗传疾病治疗、癌症研究及农业改良等多个领域展现了巨大的应用潜力。然而,如何安全且高效地将CRISPR-Cas9递送至目标细胞或组织,仍然是基因编辑领域亟待解决的挑战。
目前,病毒载体(如腺相关病毒,Adeno-Associated Virus, AAV)是体内递送CRISPR-Cas9的主要方式。然而,病毒载体的应用存在一系列问题,包括引发免疫反应、基因组整合的潜在风险以及因工具持续表达所引发的脱靶效应等。为了解决这些问题,非病毒递送策略受到越来越多的关注,尤其是脂质纳米颗粒(Lipid Nanoparticle, LNP)作为一种非病毒递送工具,因其低免疫原性、可控的递送效率和在临床中的良好安全性而备受青睐。LNP已成功应用于肝脏基因编辑,但其在其他器官中的递送效果仍有待提升。
GeoCas9的改造与优化
研究团队对GeoCas9进行了定向进化,以提升其在哺乳动物细胞中的基因编辑效率。GeoCas9本身是一种源自地芽孢杆菌的耐热性Cas9核酸酶,具有较高的热稳定性,这意味着它在较高温度下依然能够保持其结构和活性。然而,GeoCas9在哺乳动物细胞中的编辑效率相对较低,这限制了其在体内应用中的潜力。为了克服这一局限,研究团队采用定向进化的方法对其进行改造,通过多轮突变和筛选,最终开发出改进版GeoCas9,即iGeoCas9。
在该研究中,研究人员利用了一种双质粒系统进行定向进化,以筛选出具有更高编辑效率的GeoCas9变体。具体而言,这种系统通过改变Cas9的靶向序列并施加选择压力,促使Cas9产生高效的基因编辑活性。研究过程中,经过连续的多轮突变和筛选,研究人员最终成功筛选出多种具有显著优势的GeoCas9突变体。其中,改进版的iGeoCas9在多种细胞类型中的基因编辑效率显著提升。例如,在神经前体细胞(Neural Progenitor Cells, NPCs)中的编辑效率从原始GeoCas9的0.5%提升至52%,在人类胚胎肾细胞(HEK293T)中的编辑效率则从1%提高至62%。这些数据表明,iGeoCas9在多种哺乳动物细胞中展现了极高的编辑能力,极大地扩展了其潜在的应用范围。
在进一步的实验中,研究人员详细研究了GeoCas9变体GeoCas9(R1W1)的性能表现。GeoCas9(R1W1)在双链DNA(Double-Stranded DNA, dsDNA)上的切割活性显著提升,切割效率从原始GeoCas9的10%提高至85%。这一提升主要归功于特定氨基酸突变带来的蛋白质结构变化,这些变化增强了Cas9与目标DNA的结合能力,从而提高了切割效率。同时,GeoCas9(R1W1)仍然保持了良好的热稳定性,能够在较高温度下正常工作,为其在体内应用提供了重要的技术保障。
为了进一步评估iGeoCas9的性能,研究人员对其在不同温度和pH条件下的活性进行了测试。实验结果表明,iGeoCas9在37°C的生理温度下表现出最佳的切割活性,而在稍高温度(如42°C)下依然保持较高的活性。此外,iGeoCas9在pH 7.4至8.5的范围内都能够高效进行基因编辑,这表明其具有较强的环境适应性。这样的特性使得iGeoCas9非常适合在体内复杂环境中应用,尤其是在温度和pH存在一定波动的组织中,仍然能够保持高效的基因编辑效率。
在该研究中,研究人员还探讨了如何进一步提高GeoCas9的靶向特异性。通过分析Cas9与靶向DNA之间的结合机制,研究团队发现,优化sgRNA的序列能够显著提高编辑的特异性,减少脱靶效应。因此,他们对sgRNA的序列进行了系统的优化,筛选出多种在特定靶点上具有极高特异性的sgRNA组合。在实验中,这些优化后的sgRNA与iGeoCas9结合后,在目标基因的编辑效率显著提升的同时,脱靶效应显著降低,几乎未检测到明显的非特异性编辑。
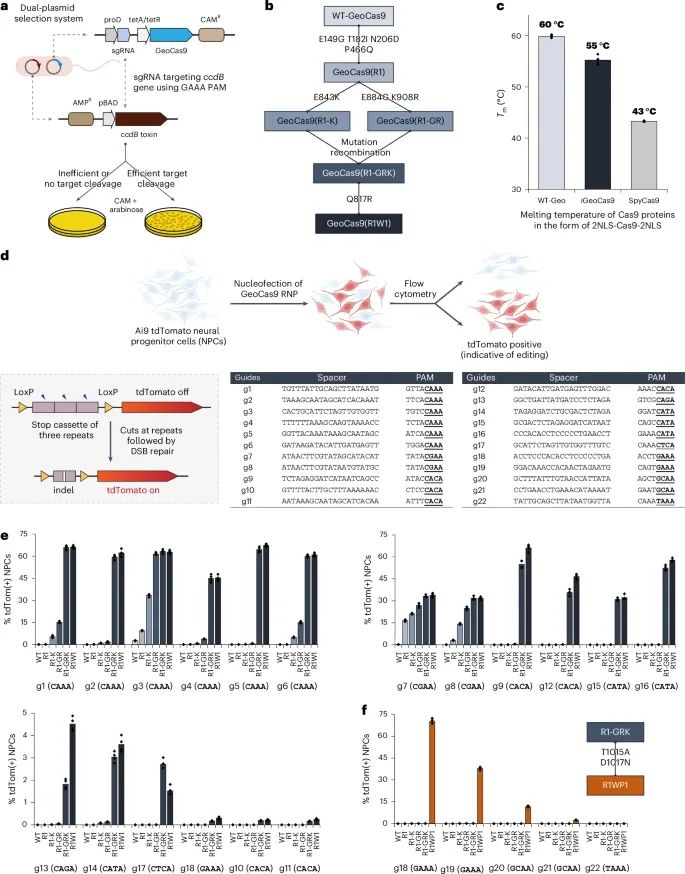
GeoCas9通过定向进化后,其基因编辑效率得到了数量级的提升,同时扩大了其PAM序列的兼容性(Credit: Nature Biotechnology)
图中展示了原始GeoCas9与改进版GeoCas9(iGeoCas9)在多种靶点和细胞类型中的编辑效率比较,表明iGeoCas9的编辑效率显著高于原始GeoCas9。此外,图中还包括了iGeoCas9对不同PAM序列的识别能力,结果显示改进后的GeoCas9能够识别更多种类的PAM序列,说明其PAM兼容性得到了显著增强。这些结果共同证明了通过定向进化,GeoCas9在基因编辑的应用范围和效率上都得到了大幅提升。
体内实验与结果
在体内实验中,研究团队利用改进后的iGeoCas9 RNP与LNP形成复合物,通过静脉注射对小鼠进行处理。具体来说,小鼠被随机分为几组,每组接受不同剂量的iGeoCas9 RNP-LNP复合物,以评估其在体内的有效性和剂量依赖性。结果显示,iGeoCas9 RNP-LNP复合物在小鼠的肝脏和肺部均实现了显著的基因编辑效率,分别达到37%和16%。在较高剂量下,肝脏的基因编辑效率最高可达45%。此外,研究人员成功在肺组织中编辑了与疾病相关的SFTPC基因(编码表面活性蛋白C),其编辑效率达到19%,显示出在肺部进行特定基因编辑的可行性。
为了进一步评估基因编辑效果,研究团队还测量了不同组织中mRNA和蛋白质水平的变化。实验结果表明,编辑后的SFTPC基因在肺组织中的mRNA表达量减少了约70%,且蛋白质水平显著降低,这表明iGeoCas9成功介导了SFTPC基因的敲除。此外,研究人员对其他非靶向组织(如肾脏、脾脏)进行了分析,发现这些组织中的基因编辑效率极低,表明LNP的组织选择性递送效果良好,能够有效减少非靶组织的影响。
为评估iGeoCas9的编辑精度,研究团队对脱靶效应进行了详细的分析。使用全基因组测序(Whole Genome Sequencing, WGS)的方法,研究人员在多个潜在脱靶位点进行了检测。结果显示,改进版的iGeoCas9在多个靶点的脱靶效应极低,几乎未检测到显著的非特异性编辑。在实验中,研究团队在超过20个潜在脱靶位点中,仅检测到微弱的编辑痕迹(<0.5%),这表明iGeoCas9的靶向特异性极高。此外,通过T7E1切割酶检测法进一步验证了这些位点的编辑情况,结果与WGS结果一致,几乎没有明显的脱靶效应。
这一发现进一步证明了iGeoCas9作为一种安全且高效的基因编辑工具的巨大潜力,特别是在体内应用方面。与传统的基因编辑递送策略(如病毒载体)相比,iGeoCas9 RNP-LNP复合物不仅显著降低了免疫原性和脱靶风险,还在多个组织中表现出卓越的编辑效率。特别是在肺部的高效编辑对于肺部疾病的基因治疗具有重要意义,显示出该方法在治疗如肺纤维化等疾病中的潜力。此外,iGeoCas9 RNP-LNP复合物在长期观察中未显示出明显的毒性反应,小鼠在处理后的四周内生理指标正常,组织学分析也未发现炎症或其他不良反应,这进一步支持了其在体内应用中的安全性。
LNP配方的优化
此外,研究人员还对LNP配方的优化对基因编辑效率的影响进行了详细探讨。研究人员通过多次实验,系统地调整了LNP的组成成分,包括脂质的种类、比例、粒径大小以及PEG(聚乙二醇)修饰等因素,以实现对不同组织的高效靶向递送。研究发现,脂质成分的调整显著影响了纳米颗粒的稳定性和靶向性。例如,使用较高比例的胆固醇能够显著提高LNP的稳定性,而通过调整阳离子脂质的比例,能够增强与细胞膜的融合,从而提高基因编辑的效率。
通过组织选择性LNP配方,研究人员实现了对不同组织的靶向基因编辑。例如,通过优化后的LNP配方,iGeoCas9 RNP在小鼠肝脏中的基因编辑效率达到了37%,而在肺组织中的编辑效率为16%。进一步的实验表明,增加PEG修饰能够有效减少LNP在肝脏中的非特异性摄取,从而提高在其他目标组织中的递送效率。在优化后的配方中,PEG-脂质的比例为5%,这一调整使得LNP在肺部的累积量增加了约1.8倍,从而显著提高了肺组织中的基因编辑效率。
此外,研究人员还对LNP的粒径大小进行了优化,发现粒径在80-100 nm范围内时,LNP在肝脏和肺部的递送效率最高。这一粒径范围内的LNP能够有效逃避肝脏中的巨噬细胞捕获,并在血液中保持较长的循环时间,从而增加了到达目标组织的概率。具体数据表明,粒径为90 nm的LNP在肝脏中的基因编辑效率达到45%,而在肺组织中的编辑效率为22%。
这种组织选择性配方的成功应用表明,通过调整LNP的成分和物理性质,可以实现对特定组织的靶向递送,从而提高基因编辑的特异性和效率。进一步的动物模型实验还显示,优化后的LNP配方在多种不同的体内环境中均表现出良好的递送效果和低毒性,特别是在长期观察中未发现明显的组织损伤或炎症反应。这些结果为未来基于LNP的基因编辑治疗提供了坚实的基础,并为不同疾病的特定组织靶向基因编辑提供了重要的技术支持。
同源重组修复的应用
该研究的另一项重要进展是利用同源重组修复(Homology-Directed Repair, HDR)进行精确的基因插入。通过将单链DNA(Single-Stranded DNA, ssDNA)模板与iGeoCas9 RNP-LNP复合物共同递送,研究人员在多种细胞类型中成功诱导了HDR,从而实现了精确的基因编辑。在神经前体细胞(NPCs)中,HDR效率达到了35%,而在人类胚胎肾细胞(HEK293T)中,HDR效率为42%。这些数据表明,iGeoCas9能够高效地介导同源重组修复,特别是在特定的体外细胞环境中表现出良好的效果。
为了进一步验证HDR的有效性,研究人员对编辑后的细胞进行了测序分析。结果显示,在所有成功编辑的细胞中,超过90%的编辑是通过HDR实现的,且目标序列的插入精度极高,几乎没有检测到非目标序列的插入。此外,实验还表明,通过调控ssDNA模板的浓度和长度,可以显著提高HDR的效率。例如,当ssDNA模板的长度为200碱基对且浓度为50 nM时,HDR的效率最高可达48%。
为了验证这种策略在体内的可行性,研究团队还在小鼠模型中进行了实验。通过静脉注射递送iGeoCas9 RNP-LNP复合物和ssDNA模板,研究人员成功地在小鼠肝脏中实现了目标基因的定点插入,HDR效率约为20%。这一结果展示了iGeoCas9在体内环境中诱导HDR的潜力,为未来在遗传性疾病的基因治疗中应用HDR提供了重要的技术支持。
总体而言,利用HDR进行精确基因插入的策略为未来基因治疗的应用提供了新的可能性,尤其是在需要修复致病突变的遗传性疾病的治疗中。这一策略通过高效的同源重组修复实现了精确的基因插入,在体内和体外均展现了良好的应用潜力。
总体而言,该研究展示了一种新型的基因编辑递送策略,结合了耐热性GeoCas9的高效编辑能力和脂质纳米颗粒的高效递送特性。通过对GeoCas9的工程化改造以及LNP配方的优化,研究团队成功实现了对多种细胞和组织的高效基因编辑,显著降低了脱靶效应和毒性。这一成果为CRISPR基因编辑在遗传疾病治疗中的应用提供了新的方向,也为未来开发更加安全、有效的基因编辑工具奠定了基础。GeoCas9 RNP-LNP复合物的成功应用展示了其在体内基因编辑中的广阔前景,未来有望成为新一代基因编辑治疗的有力工具。
参考文献
Chen, K., Han, H., Zhao, S. et al. Lung and liver editing by lipid nanoparticle delivery of a stable CRISPR–Cas9 ribonucleoprotein. Nat Biotechnol (2024).
https://doi.org/10.1038/s41587-024-02437-3


