多发性骨髓瘤的癌前状态:发展史、定义、风险分层和管理
时间:2024-10-20 15:01:48 热度:37.1℃ 作者:网络
在20世纪60年代,通过以实验室为基础的外周血检查和详细的临床注释,Waldenstrom博士描述了一种他称之为“良性单克隆丙种球蛋白病(benign monoclonal gammopathy)”的疾病。这些患者无症状,可检测到单克隆蛋白,不符合多发性骨髓瘤的影像学和实验室标准。1978年,通过对医疗记录的回顾性观察,Kyle博士发现并非所有单克隆丙种球蛋白病都是良性的,从而引入意义未明单克隆免疫球蛋白血症(MGUS)的术语来描述这种可能发展为多发性骨髓瘤(MM)的疾病,强调了临床无法预测哪些患者可能会发展。1980年, Kyle和Greipp报道了6例不符合MGUS或MM定义的病例,随访至少5年后仍无症状,定义为冒烟型多发性骨髓瘤(SMM)。目前已开发出多种临床评分来定义进展为MM的高危人群,但由于进展统计模型仅提供平均风险评分,而由于个体水平的进展风险仍然未知,因此临床效用有限。医师-科学家正专注于全基因组测序、肿瘤微环境分析和单细胞RNA测序等新兴技术,从而在分子学水平了解癌前(precursor)状态,并更好地确定单克隆丙种球蛋白病和其他骨髓瘤癌前状态,临床医师能够提供更精确、个体化的风险评估,并最终改善患者预后。 《Blood Reviews》近日发表综述,概述了MM癌前状态的历史、目前的定义、风险分层模型面临的挑战、临床管理,以及新兴技术在提高预测和结局方面的作用。

前言
多发性骨髓瘤(MM)是第二常见的血液肿瘤,其发病前总是有其癌前疾病MGUS。MGUS的患者的个体结局的可预测性仍然存在不确定性:蛋白质水平会随时间变化多少?如何确定哪些患者的蛋白质水平会随着时间的推移而发生器官受损?血清MGUS值相似的个体发展为MM的可能性是否相同?这些问题对于努力理解既非恶性也非完全良性的现象来说至关重要。
目前MGUS的定义是存在可检测的单克隆蛋白,血清M蛋白水平<3g /dL,骨髓(BM)克隆浆细胞(PC) < 10%,没有可归因于该疾病的终末器官受损。终末器官受损可通过与该疾病相关的CRAB特征(贫血、高钙血症、溶骨性病变、肾功能不全)来确定。此外,SMM为MGUS和MM之间的中间阶段,可通过血清M蛋白≥3g /dL和/或克隆性骨髓浆细胞(BMPC)在10%至60%之间来确定,且无终末器官受损(CRAB标准)或其他骨髓瘤定义事件(MDE),如骨髓浆细胞百分比≥60%、受累/未受累血清游离轻链比值≥100,和/或MRI上出现1个以上局灶性病变;通过血清M蛋白水平和克隆性BMPC的百分比可将其与MGUS区分。SMM患者需要自己的分类,因为与MGUS患者相比,其进展为MM的风险明显更高。虽然从MGUS到MM的进展率约为每年1%,但SMM患者在前五年的进展率约为每年10%。
大多数MGUS可保持稳定而不发生进展。2009年,一项前瞻性筛查调查(N>77000)表明,所有诊断为MM的患者都曾被诊断为MGUS。在真实世界中,绝大多数患有MGUS的个体都不知道诊断,因为目前没有推荐检测MGUS的筛查指南。目前有多种临床风险评分模型可用于预测从MGUS进展为MM的机会,但应强调,这些临床评分仅可提供特定风险组(例如低危组与高危组)中所有个体进展风险的平均估计。目前的临床风险评分是基于肿瘤负荷(骨髓PC百分比)和/或替代标记物水平(如单克隆蛋白水平或游离轻链比)等因素,对于识别疾病负荷较低但仍可能进展的MGUS患者无效。事实上,这些风险评分提示,与疾病负荷较低的患者相比,疾病负荷较高的患者进展为MM的风险更高。尽管如此,疾病负荷较低的患者也可能进展为MM,尽管风险较低,但许多疾病负荷较高的人也可能永远不会发展为MM。这些评分为风险评估提供了有价值的见解,但由于疾病进展的内在复杂动态,还无法为个别病例提供确定性。开发个性化分析或统计模型来预测从MGUS发展为多发性骨髓瘤的个体风险,仍是未满足的医学需求。
对MM基因组风险标志物的临床评估主要强调通过荧光原位杂交(FISH)检测出特定的高危细胞遗传学异常,如t(4;14)、t(14;16)、染色体1q获得和染色体17p缺失,它们在MM的发病机制中起着重要作用,并与临床试验结局相关。但它们无法一致性区分高危和低危MM,也无法可靠地预测癌前状态的进展,因此需要更全面的方法来加强MM的风险分层模型。
精准风险分层及区分稳定性和进展性癌前状态存在挑战,并由于临床病理指标的分辨率有限而变得更加困难。二代测序(NGS),尤其是全基因组测序(WGS)的出现,再加上对肿瘤微环境的更深入理解,导致在疾病进展的不同阶段分析骨髓瘤基因组的能力发生了革命性的变化。这些进展以及其他新兴技术有可能解决仍未解答的问题。
骨髓瘤癌前状态的出现阐述了两大学派的思想
MGUS的历史可以追溯到内科科学家Jan Waldenstrom博士和临床化学家Carl-Bertil Laurell博士的早期工作。在1944年的论文《初发骨髓瘤病还是“原发性”高球蛋白血症伴纤维蛋白原减少——一种新的综合征?》中,Waldenstrom描述了几例血液粘度升高的病人,并推测这是由于球蛋白的增加;证实2例患者的血液中含有巨球蛋白,或称为“高分子量血浆球蛋白”(最终称为华氏巨球蛋白血症)。Waldenstrom和Laurell深入研究了丙种球蛋白紊乱的情况,重点研究了单克隆与多克隆丙种球蛋白病的临床表现。
通过科学和临床的努力,出现了两种主要的思想流派。在20世纪60年代,Waldenstrom假设,可检测到单克隆球蛋白的患者没有症状、没有终末器官受损的证据,构成“良性单克隆丙种球蛋白病”,他认为其MM无关。临床医生Kyle博士则反驳这一思想流派,他认为“良性”一词可能并不完全合适,因为无法预测患有单克隆丙种球蛋白病的个体是否会发展为MM。Kyle在他1978年的报道中分享了一项研究的发现,他回顾了1971年1月1日之前在梅奥诊所诊断为单克隆丙种球蛋白病的241人的病程,经过至少5年随访后发现:
1. 137例(57%)患者的M蛋白水平保持稳定。
2. 22例(9%)患者的M蛋白水平升高≥50%。
3. 27例(11%)患者出现多发性骨髓瘤(MM)、WM或AL型淀粉样变性。
4. (23%)患者在完成5年随访血清学检测前死亡。
Kyle指出,在恶性肿瘤发展之前,发展为MM的个体经常伴随着症状和单克隆蛋白增加。基于这些观察结果,他认为“意义未明的单克隆丙种球蛋白病”是更合适的术语,因为它可更准确地反映M蛋白的不确定性——会保持稳定还是会随着时间的推移而增加(图1),并最终进展为MM。这些早期临床观察结果均不包括分子标志物——用于区分稳定性与进展性癌前模式。
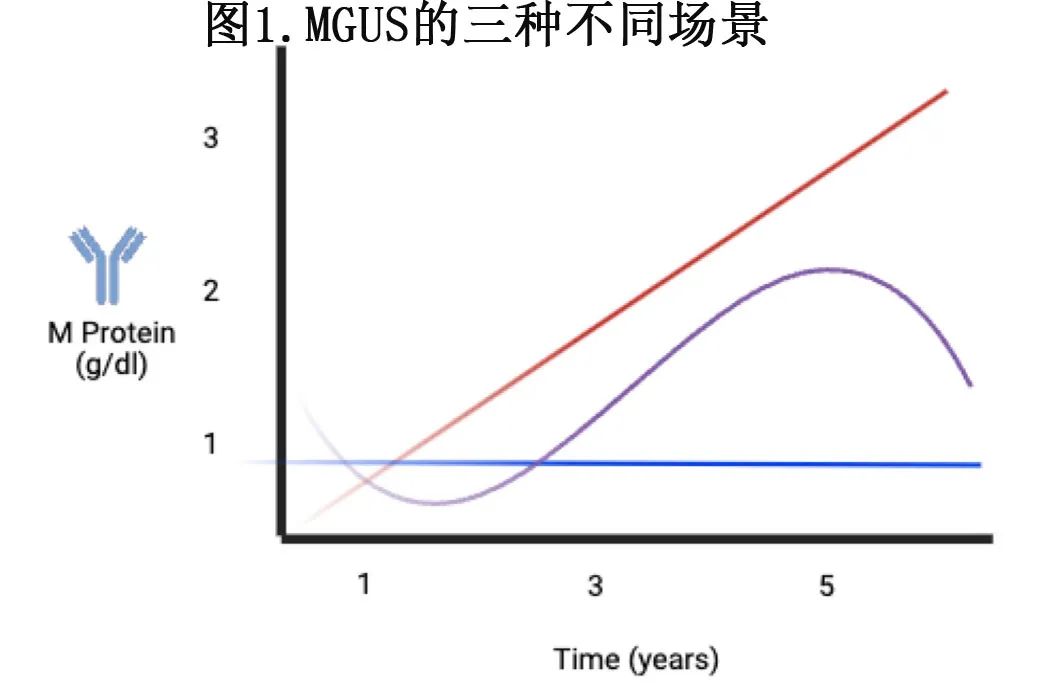
MGUS和其他单克隆癌前状态的定义、流行病学和临床指南
骨髓瘤癌前状态的当前定义
所有MGUS亚型都有以下共同标准:血清M蛋白浓度<3g/dL,骨髓单克隆浆细胞<10%,无终末器官受损。国际骨髓瘤工作组将MGUS分为三大类:非IgM型MGUS、 IgM型MGUS和轻链型MGUS。
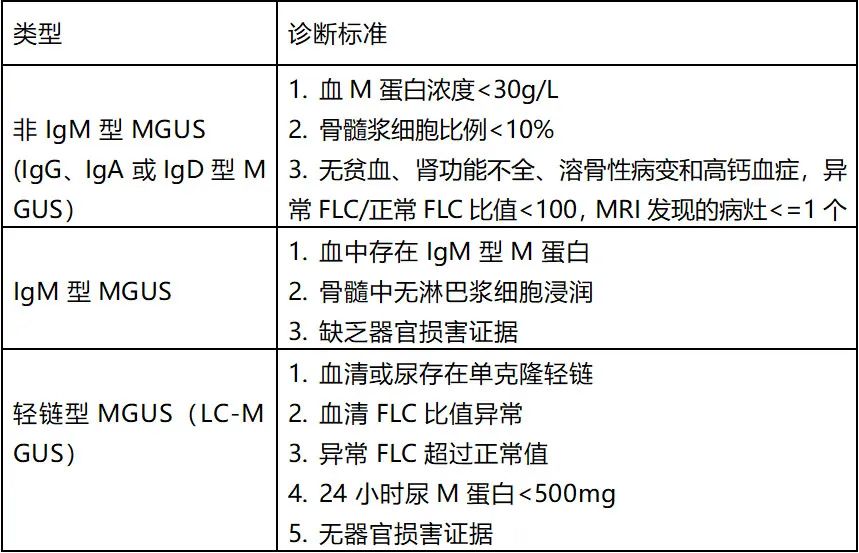
非IgM型MGUS包括IgG、IgA、IgD和IgE MGUS,无终末器官受损,如溶骨性病变、贫血、高钙血症、肾功能障碍或高粘血症。
IgM型MGUS的特点为血清中存在IgM单克隆蛋白,无贫血、全身症状、高粘血症、肝脾肿大或可能提示淋巴细胞增生性疾病(最常见的是WM)的其他终末器官受损迹象。从IgM型MGUS进展为MM的病例不到0.5%。
轻链型MGUS可通过κ/λ游离轻链比异常(低于0.26或高于1.65)、相关轻链水平升高、免疫固定电泳无免疫球蛋白重链表达、无终末器官受损(CRAB症状)或浆细胞紊乱引起的淀粉样变来识别。
应注意的是,游离轻链升高亦可见于浆细胞疾病以外的其他疾病,包括炎症状态、肾脏疾病、自身免疫性疾病等;肾脏清除率降低也会使轻链水平和/或比例发生异常,导致对轻链型MGUS(后续发展为解剖性或内源性肾损伤)的个体进行监测成为一项挑战。MM的其他癌前状态包括孤立性浆细胞瘤、孤立性浆细胞瘤伴微小骨髓浸润(solitary plasmacytoma with minimal marrow involvement)、POEMS综合征和系统性AL型淀粉样变性。
SMM是一种生物学异质性疾病,是一种临床定义的疾病,包括生物性癌前病变(即MGUS)和生物学恶性肿瘤(即MM)患者,这些患者尚未发生器官受损或骨髓瘤定义事件。SMM的诊断必须同时满足两个标准:血清单克隆蛋白(IgG或IgA) ≥3g/dL或尿单克隆蛋白≥500mg/24h和/或克隆骨髓浆细胞10-60%;无骨髓瘤定义事件。骨髓瘤定义事件包括CRAB特征和:
克隆性骨髓浆细胞百分比≥60%
受累/未受累血清游离轻链(FLC)比>100(前提是受累FLC的绝对水平至少为100mg/L)。
MRI检查发现一个以上局灶性病变(每个病变>5 mm)。
SMM与MGUS的区别主要是由于临床原因,因为在诊断后的前5年内,SMM发展为MM的风险为每年10%,而MGUS为每年1%。
对癌前状态进行风险分层存在挑战
MGUS和SMM为异质性疾病,具有复杂的变化和许多未知因素,因此很难确定哪些患者更容易发展为MM。这一挑战有几个因素,包括癌前异质性、生物学变异性、临床因素、时间演变和诊断复杂性。根据长期随访的回顾性研究,从MGUS到MM的年平均风险为0.5-1.0%。这些旨在确定疾病进展危险因素的研究中,大多数依赖于使用单个时间点(通常是初诊时)风险数据的统计学模型。继Kyle于1978年的报道之后,更多的回顾性研究提示,M蛋白的不断变化与进展为MM相关,然而在大多数临床实践中,患者都是根据初诊时捕获的危险因素进行咨询。此外,轻链型丙种球蛋白病对MGUS风险分层提出了进一步的挑战,其与具有明确M蛋白的MGUS遵循不同的模式,目前关于从轻链型MGUS进展为轻链型MM的风险知之甚少。
最后,对癌前状态进行风险分层的主要局限性在于领先时间偏倚(lead-time bias,由于筛检试验提前发现了那些尚未发展到明显疾病而来主动就医的病人,如果忽略这一点,在比较筛检查出的病人及来医院就诊病人的存活期、病死率、治愈率等等,就可能因为领先时间偏倚而使结果偏离真实情况),因为初级保健机构中不存在筛查指南。事实上,患者很多是在因不相关疾病进行检查时,或在因肾损伤、贫血和其他实验室检查时偶然诊断出疾病。
来自前瞻性研究的见解和当前疾病进展模型的开发
2009年发表了第一项针对MGUS患者的前瞻性、基于人群的筛查研究,包括来自国家癌症研究所前列腺癌、肺癌、结直肠癌和卵巢癌筛查试验(NCI PLCO)的77000多名成年人,包括在多个时间点收集血清样本。该研究确定了MGUS始终发生在MM之前,标志着从MGUS到MM的进展方面取得了重大进步,并为未来研究这一转变的分子机制和临床生物标志物奠定基础。一项同样基于NCI PLCO研究的后续纵向研究于2019年发表,检测了MGUS患者血清标志物的动态变化,包括单克隆蛋白、游离轻链和定量免疫球蛋白。结果显示,从MGUS(包括轻链型MGUS)发展为MM的风险是可变的,而非恒定。通过分析前瞻性收集的年度样本,该研究表明患者的临床风险类别可随着时间的推移而变化,低危或中危MGUS可能在5年内演变为高危MGUS并进展为MM。该发现至关重要,并凸显了仅基于初始检查值对患者进行风险分层的不准确性。
在2019年NCI PLCO研究的扩展随访中,初步分析涉及对先前回顾性研究中血清免疫标记物的横断面检查,这些标志物整合到一个统计模型中,使用距离MM诊断日期最近的时间点之前的测量值来评估它们与疾病进展风险的关联,还进行了纵向分析,以确定这些血清标志物随时间的变化模式。基于从横断面研究中获得的累积分数设计了一种评分机制,表1为MGUS进展标志物评分。
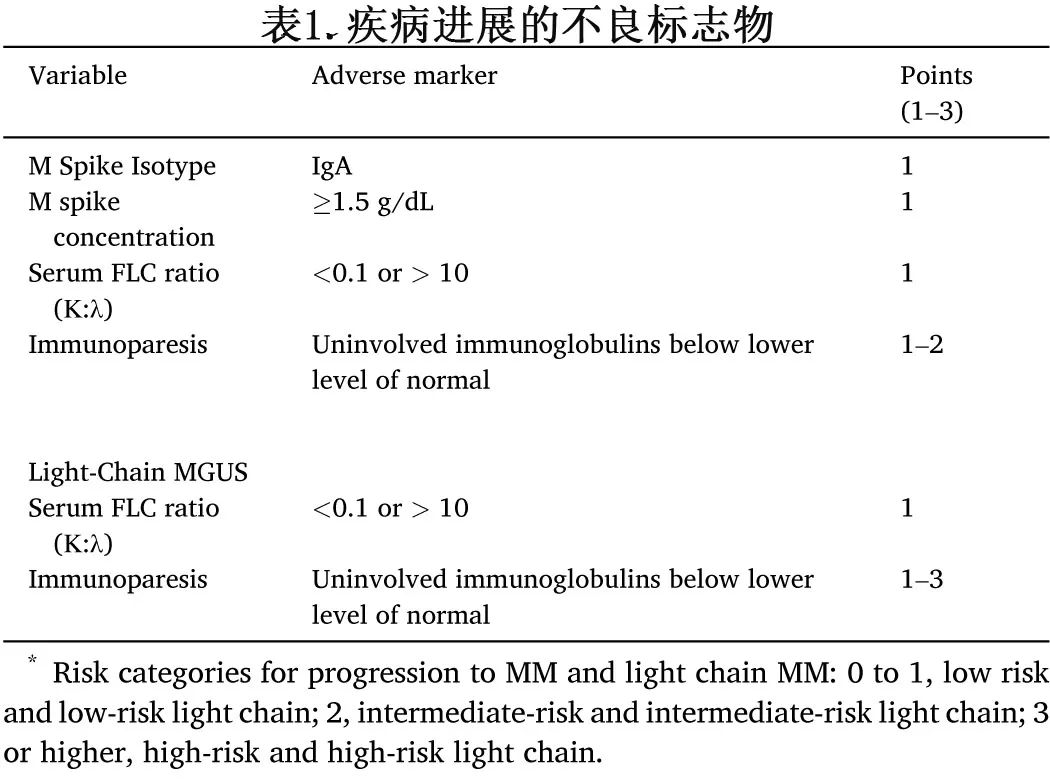
使用这个评分系统可以评估进展风险,53%的进展性MGUS患者在诊断时为高危,而非进展性MGUS患者中仅为0.93%。同样,70%的进展性轻链型MGUS患者为高危,而非进展性轻链型MGUS患者中只有0.83%为高危。该研究的一个关键发现在于,对于大多数归为高危MGUS后发展为MM的个体,在被诊断为MM之前的五年内已经从低危或中危MGUS发生转变。尽管大多数由 MGUS 和轻链 MGUS 进展为 MM 的个体在五年内表现出血清免疫标志物增加,但只有一小部分血清标志物升高不到一年;具体来说,从MGUS进展为MM的患者中9%在MM诊断前一年为低危,从轻链型MGUS进展为轻链型MM的患者中10%在诊断前为低危。此外,该研究显示,从MGUS过渡到MM的个体中,只有21%在MM诊断前符合SMM的诊断标准。
SMM进展的风险模型
来自梅奥诊所的数据表明,前5年从SMM发展为MM的风险约为每年10%,此后风险随着时间的推移而降低。在回顾性研究中评估了各种参数来预测进展:M蛋白大小、受累重链类型、受累血清游离轻链(sFLC)比以及受累和未受累FLC之间的差异、是否存在免疫麻痹不全、骨髓克隆性浆细胞百分比、尿轻链排泄、循环浆细胞,以及荧光原位杂交(FISH)检测到的异常。对预测疾病进展的可靠工具的需求推动了各种风险分层模型的开发。此外,在当前诊断标准的背景下,考虑每年10%的SMM进展风险的适用性也很重要。给出最初的进展风险估计值的研究中,包括了如今已经归为MM而非SMM的患者,因此每年10%的进展率可能过高,因为与历史上的SMM队列相比,现在的MM的患者可能具有本质上不同的进展模式。这种诊断阈值的变化可能会导致对SMM进展率的高估,因为如今MM的患者的进展动力学可能与最初诊断为SMM的患者有很大不同。
虽然细胞遗传学分析仍是理解多发性骨髓瘤的基础,但它可能无法预测从MGUS或SMM等癌前状态到MM的进展,这种局限性是因为许多与MM相关的突变在癌前阶段就已经存在。因此,在SMM中观察到的细胞遗传学异常通常与MM中没有显著差异,导致它们在预测疾病进展方面的效果较差。此外,SMM的基因状况可能会随着时间的推移发生变化,出现现有细胞遗传学方法可能无法捕捉到的新突变。为了提高预测准确性,将细胞遗传学与其他先进的诊断工具和生物标志物结合起来非常重要。
表2总结了三种用于预测MM疾病进展的预测模型。需要注意的是,基于单次检测就决定开始治疗对个体患者并非最优,最好随着时间的推移记录多次结果,以更好地了解进展的风险,因此这些进展模型主要用于临床试验。在临床实践中一般根据个体情况做出最佳判断。

癌前状态的筛查和管理
正在进行的研究重点在于了解筛查对低、中、高危癌前状态的影响。目前只有约5%的MM患者有先前确定的癌前疾病,从而限制了大多数病例的早期干预机会。为了解决这个问题,iStopMM(冰岛筛查、治疗或预防多发性骨髓瘤)研究已被建立为一项大规模的、基于人群的MGUS筛查计划,其目标是确定在进展为MM之前可能从潜在治疗中获益的个体。该研究的参与者随机分配到以下三组之一:不接受进一步检查、根据现行指南进行随访或进行更密切的监测。该研究不仅有助于识别哪些患者的疾病进展风险较高,还可揭示早期筛查的潜在获益和风险。目前MGUS和SMM没有标准治疗,鉴于高危癌前状态的进展风险,特别是高危SMM,专家通常会将这些个体纳入临床试验。然而确定哪些人应该接受治疗仍具有挑战性,从而强调了需要关于这些癌前状态的更详细生物学信息。
癌前状态的临床意义和对个体的意义
诊断MGUS可能会引起患者的严重焦虑,主要是由于疾病进展的不确定性。关于MGUS是否会演变为MM或保持良性的模棱两可会导致心理困扰。在常规监测期间,即使是检测结果的微小波动也会加剧这种焦虑,因为患者可能会将这些变化视为疾病进展的迹象。目前所有MGUS患者都作为一个同质组进行治疗,尽管临床承认MGUS个体之间存在分子学和遗传学差异,但这些差异在现有的风险评估模型中并未得到充分体现。缺乏个体化评估意味着一些进展风险较高的患者可能没有得到必要的关注,而其他风险较低的患者可能承受不必要的焦虑和干预。应认识到某些MGUS患者可能经历快速进展,尽管疾病负荷很小,而一些SMM患者可以保持稳定,尽管疾病负荷更高(类似于MGUS的行为)。因此,除了骨髓浆细胞百分比和血清标志物之外,如果能识别这些不同的临床模式,则将极大地促进临床实践。上述正在进行中的iStopMM研究在基于人群的骨髓瘤癌前疾病筛查的背景下,还收集生活质量、焦虑和其他相关因素的指标。
新技术的努力和未来方向
最近的临床和科学努力从不同的角度探讨了MGUS向MM的进展。值得注意的是,全基因组测序、肿瘤微环境研究和单细胞RNA测序都提供了有价值的见解,预计这些进展将有助于开发更精确的个体化预测模型。
目前针对MM及其癌前状态的基因组风险标志物的临床评估,主要针对与临床试验结局相关的特定细胞遗传学异常,包括通过FISH检测的t(4;14)和t(14;16)易位、gain(1q)、13q缺失和17p缺失。全基因组测序(WGS)表明,表达这些细胞遗传学变化的MGUS和SMM队列到MM进展的时间更短。二代测序的出现彻底改变了这一领域,从而能够对遗传学改变进行更全面和详细的分析。
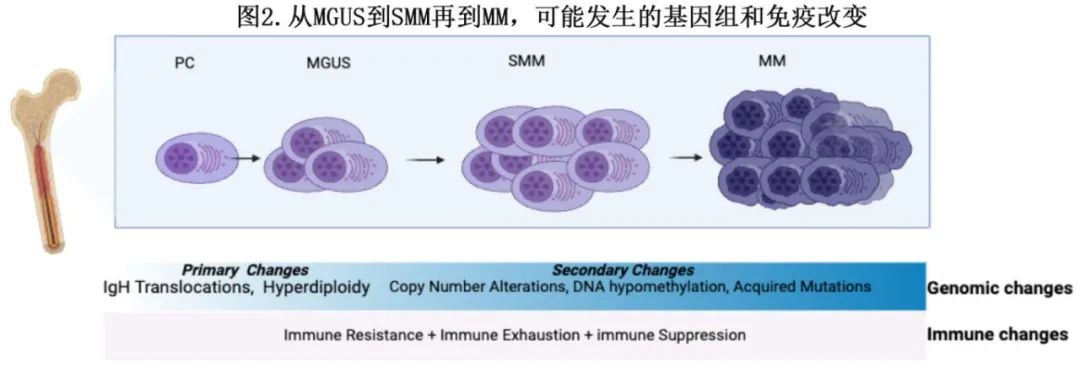
在2021年的一项研究中,Oben等分析了18名MGUS患者的全基因组测序(WGS)谱,并将其与14名SMM患者和80名MM患者的谱进行比较。结果表明,无进展、临床稳定的癌前疾病(n=15)通常在患者生命后期开始,并以缺乏关键的骨髓瘤相关基因组事件(包括染色体畸变、模板插入、驱动基因突变、非整倍体和典型的APOBEC突变活性)为标志。遗传事件的分布揭示存在显著差异,凸显出存在两种生物学和临床上截然不同的无症状单克隆丙种球蛋白病:第一种类型的特征为存在大量骨髓瘤相关基因组改变,表明有恶性潜能,并与疾病进展相关;而第二类型的遗传改变较少,病程往往较长、惰性且临床上稳定。从肿瘤微环境的角度来看,骨髓微环境中的成骨细胞和其他细胞可能在驱动MGUS患者浆细胞的早期突变中发挥作用(图2),但浆细胞开始向致癌细胞转化所需的骨髓细胞中的特定遗传改变仍未确定。Samur等阐明了从MM单细胞图谱中获得的重要见解,提供了MM内克隆多样性的详细图谱,使研究人员能够追踪不同克隆随时间的进化;还研究了克隆进化如何促进治疗耐药,揭示了与耐药相关的特定遗传改变经常出现在亚克隆中,并随着治疗进展变得更加普遍,最终导致治疗失败。
目前的工作重点是开发基于血液的方法,以简化在临床环境中识别定义骨髓瘤的基因组事件,这些方法包括但不限于液体活检、游离DNA(cell-free DNA)和ct DNA分析以及游离浆细胞RNA(plasma cell-free RNA)谱分析。这些技术旨在改善早期检测,实现个性化治疗策略,并加强持续的疾病监测。
Maura等开发了第一个个体化风险模型,使用基因组骨髓瘤定义事件来帮助预测MM的临床结局。目前还没有经过验证的方法,而且有限的可用数据表明假阴性率太高,不适合临床使用。目前正在努力开发个性化的风险模型,利用个体患者的基因组图谱,预测从MGUS/SMM到MM的进展。还需要开展进一步工作,推进用于识别和纵向追踪基因组异常的基于血液的检测方法的开发。向前推进、改进的、以生物学为导向的策略对于在克隆扩增之前准确识别有进展性骨髓瘤癌前疾病的患者至关重要,从而在终末器官受损或其他定义骨髓瘤的生物标志物出现之前更早地启动治疗,预防严重的临床并发症。
分子学分析极大地提高了对MM的认识,但仍有显著的局限性,其中一个主要问题在于完全确定患者体内克隆异质性的挑战。虽然目前的方法可以精确地确定显性克隆及其突变,但它们往往遗漏较小的瞬时克隆,导致对疾病复杂性的理解方面留下空白,并使靶向治疗的开发更加困难。而技术挑战也依然存在,例如难以检测低频突变和罕见亚克隆。此外,由于MM随时间推移而演变,在单个时间点进行的分析可能无法捕捉到疾病的动态本质。整合来自不同组学方法(如基因组学和蛋白质组学)的数据增加了另一层复杂性,因为它需要复杂的工具和专业知识。最后,由于靶向治疗的可用性有限和个体患者差异等问题,将这些分子学认识转化为实际的临床策略可能很困难。总体而言,解决这些局限性是提高MM诊断和治疗准确性和有效性的关键。
实践点
•在目前的临床实践中,医生无法为MGUS或SMM患者提供准确的个体进展风险,因为目前的风险分层模型仅提供平均进展风险。
•MGUS和SMM具有动态基因组特征,更详细地了解这些个体基因组的变化就能够确定哪些患者有更高的风险进展为MM。
•更清楚地了解MGUS和SMM的基因组变化和肿瘤微环境有助于识别高危患者进行并早期干预,同时使低危患者免于不必要的治疗。
研究议程
•正在开发基于血液的方法,目的是在临床环境中更容易识别骨髓瘤定义的基因组事件。
•需要开展更多工作来促进基于血液的检测方法的开发,以识别和纵向追踪基因组异常。
•展望未来,通过改进的和以生物学为导向的策略,在克隆扩增前准确识别进行性骨髓瘤癌前患者,可以实现:
在终末器官受损或其他定义骨髓瘤的生物标志物出现之前更早地开始治疗,从而避免严重的临床并发症并显著改善患者预后。
防止有癌前疾病的患者被过度监测(即无临床意义的检测和预约)和过度治疗(即对不治疗也不会进展的患者进行治疗),减少不必要的压力和潜在的副作用,从而提高总体生活质量。
参考文献
Gil Hevroni et al., Blood Reviews, https://doi.org/10.1016/j.blre.2024.101242


