导管室惊魂——急诊PCI遭遇肝素抵抗
时间:2024-10-20 23:00:11 热度:37.1℃ 作者:网络
病例资料
患者男性,64岁,因突发胸痛6小时入院。
6小时前,无明显诱因出现胸痛,位于胸骨后,向左肩部及后背部放射,大汗淋漓,伴头晕、恶心、呕吐,持续不缓解,急呼120接入。
10:52 入大门
10:58 首次医疗接触
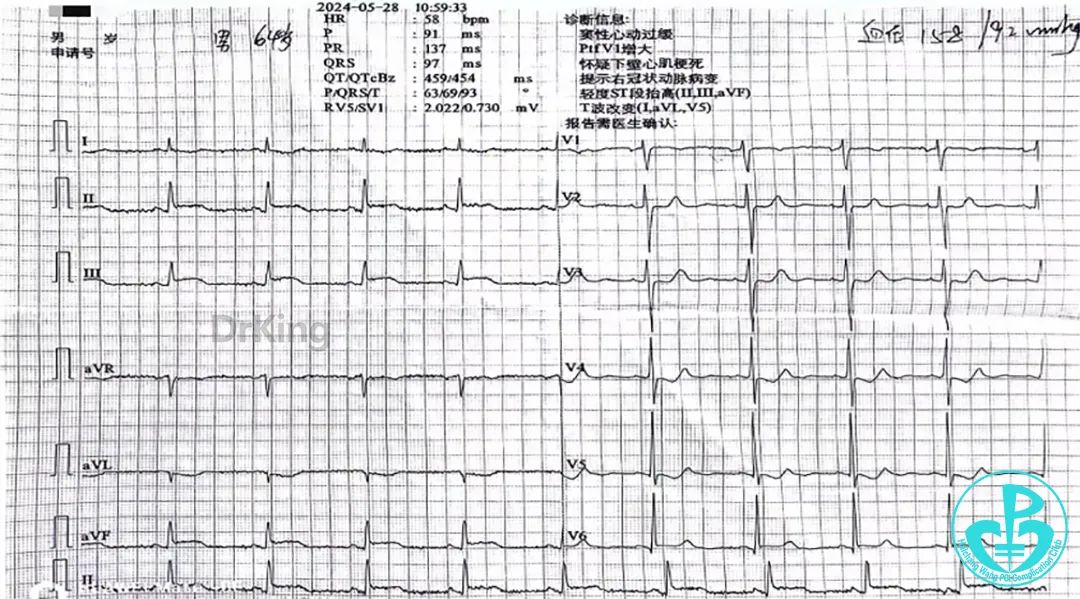
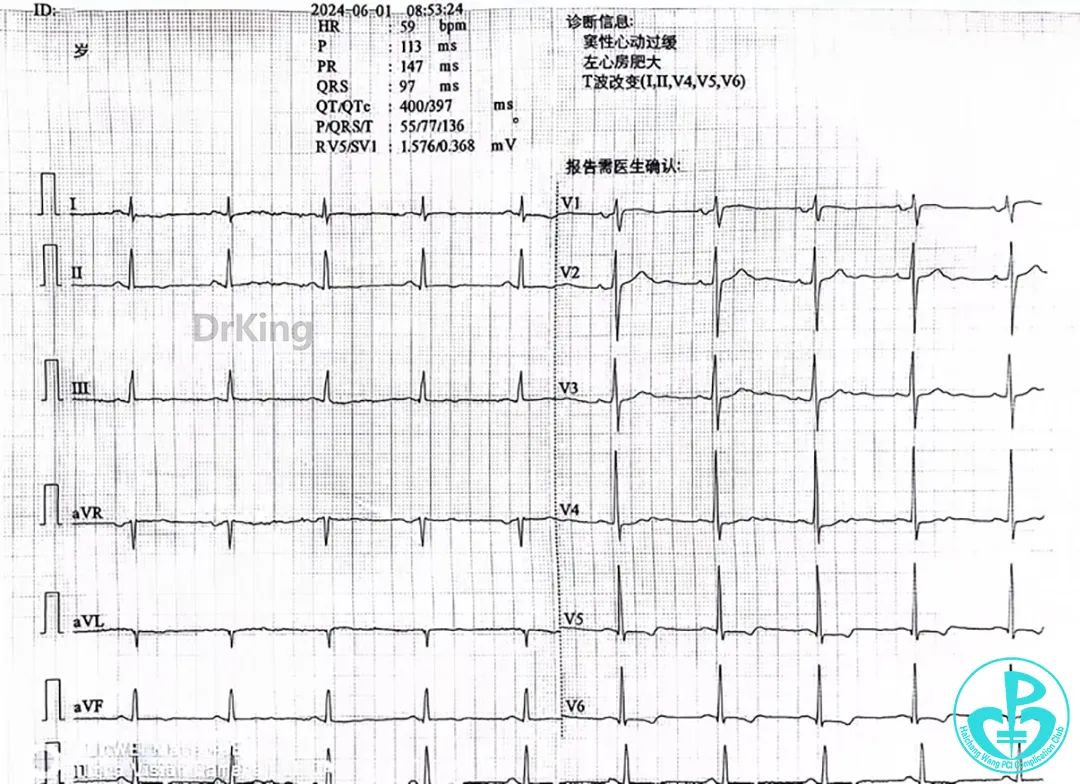
10:59 心电图提示窦性心律,Ⅱ、Ⅲ、aVF导联ST段弓背抬高约0.1mV,T波异常,考虑急性ST段抬高型心肌梗死
11:05 给予氯吡格雷片300mg、阿司匹林肠溶片300mg嚼服
11:06 肝素4000U静注
既往无高血压,糖尿病,脑血管病史。
吸烟40年,平均10支/天,未戒烟。
入院查体:T 36.5℃,P 61次/分,R 20次/分,BP 140/70mmHg。
首份心电图:

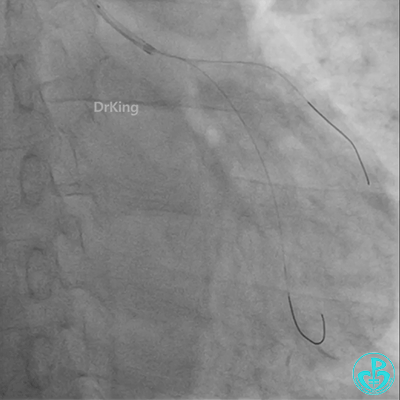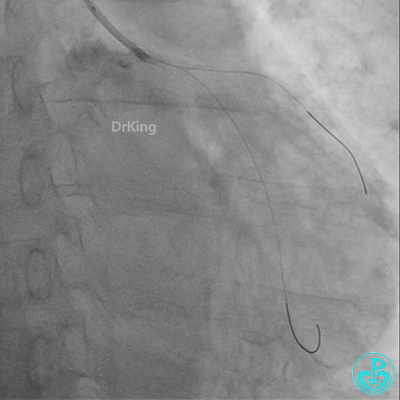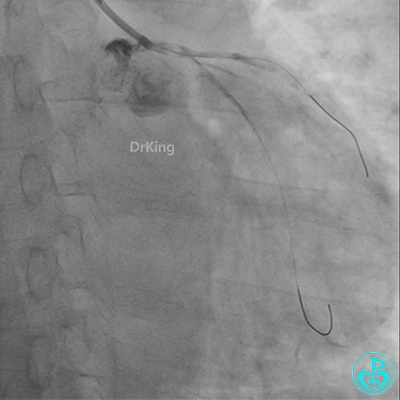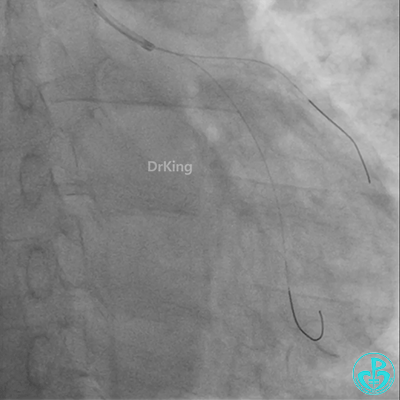
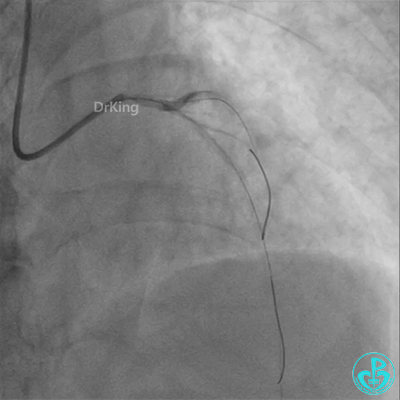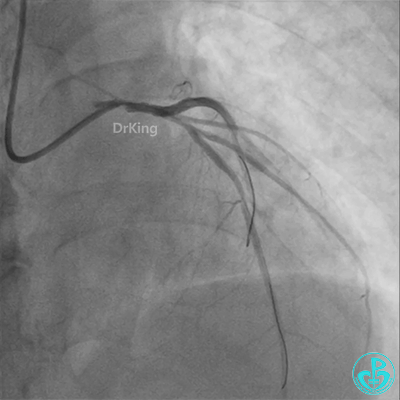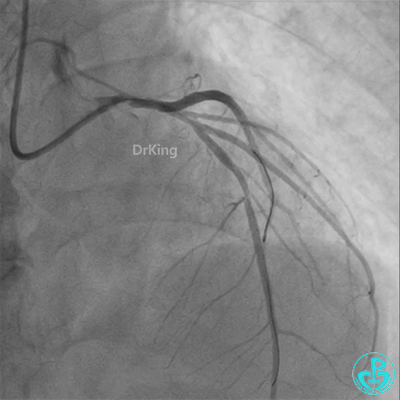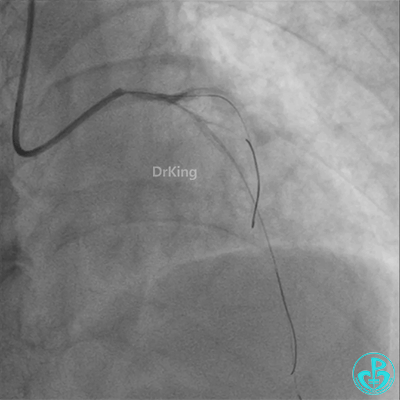
冠脉造影
治疗过程
噩梦开始!
发现冠脉导管里出现血栓,撤出导管导丝,又追加肝素3000U,替罗非班10ml静脉注射,重新导丝通过病变。
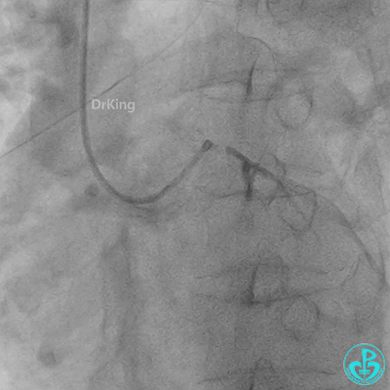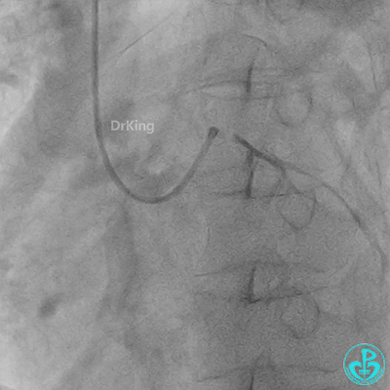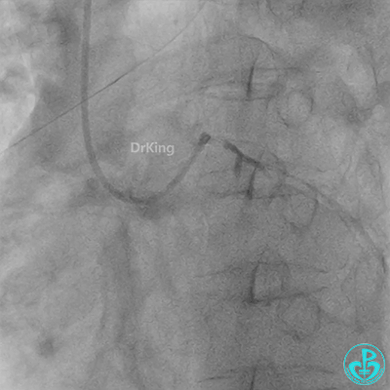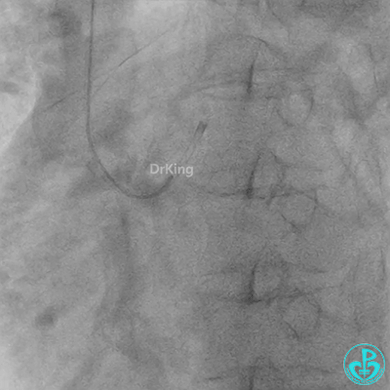
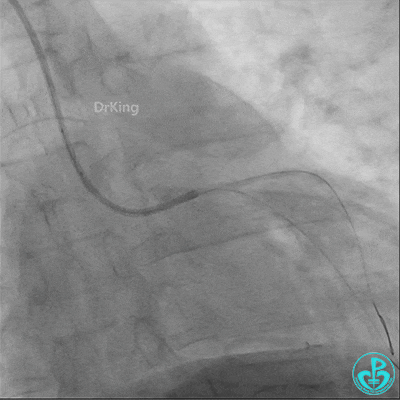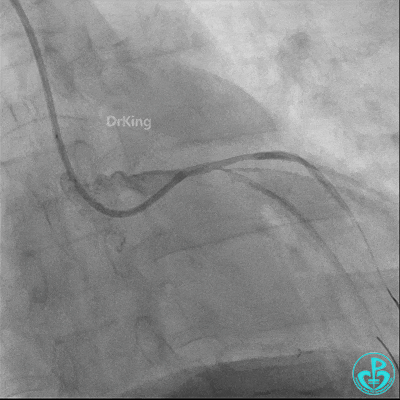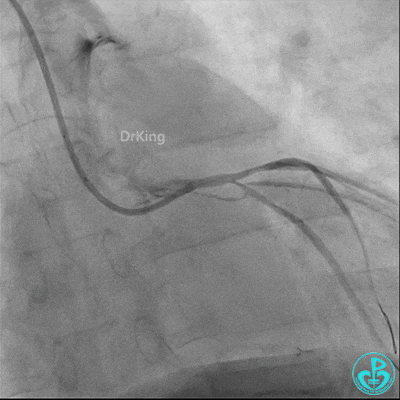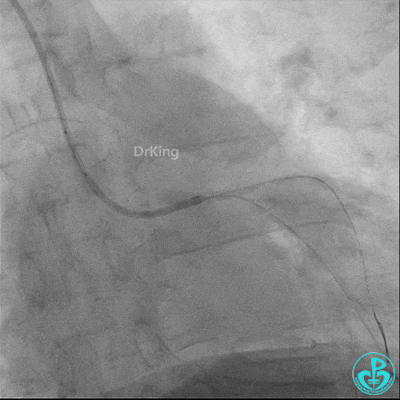
球囊扩张后血栓消失,马上血栓再生。立即冠脉内给予替罗非班20ml,TNK 8mg。
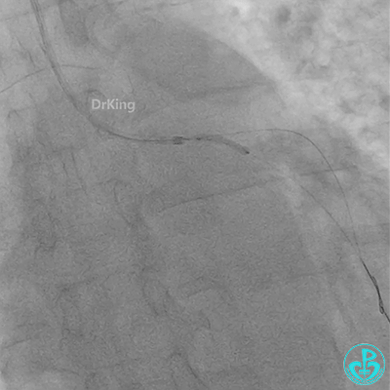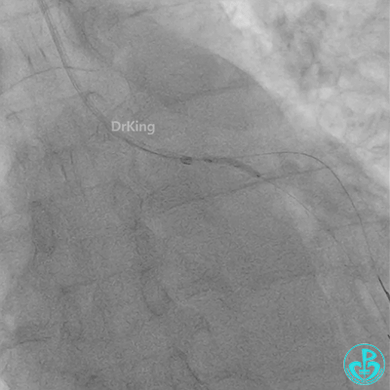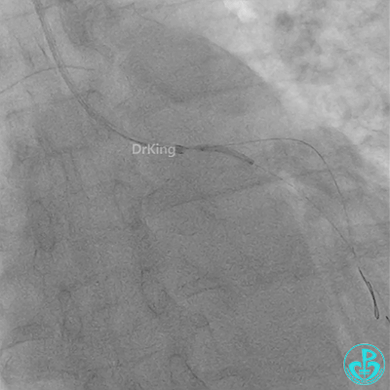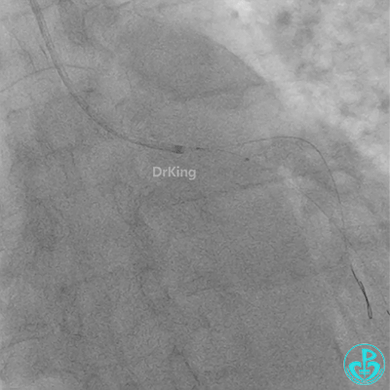
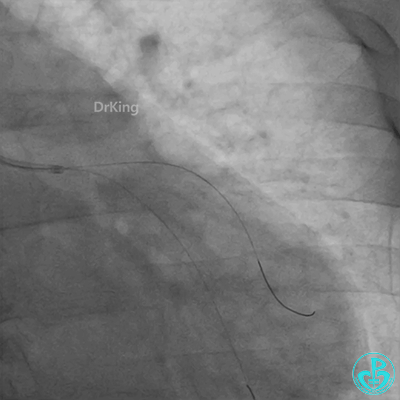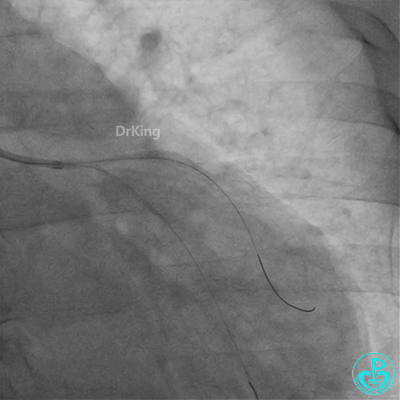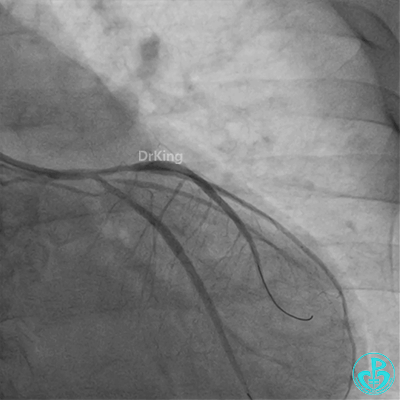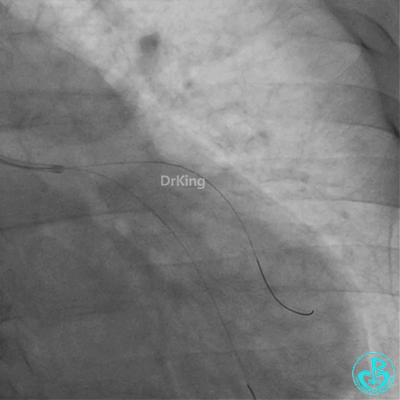
惊魂时刻!
患者心率慢、血压低,烦躁不安,立即冠脉内给予比伐芦定(0.25+氯化钠50ml)20ml,静脉注射10ml,持续泵入50ml/h,多巴胺、去甲肾上腺素等血管活性药物应用。
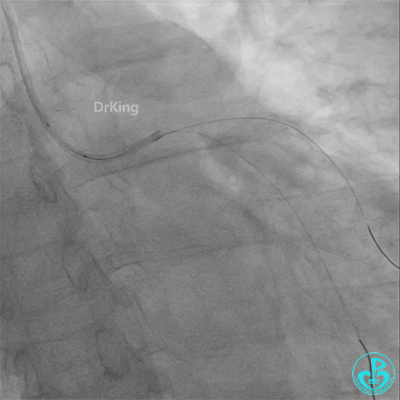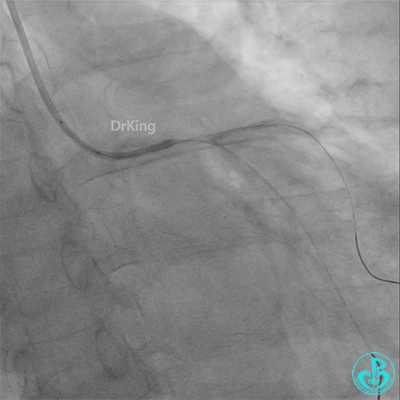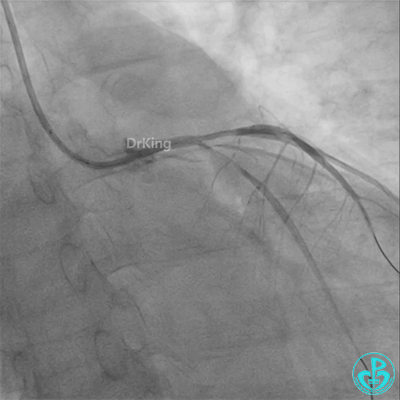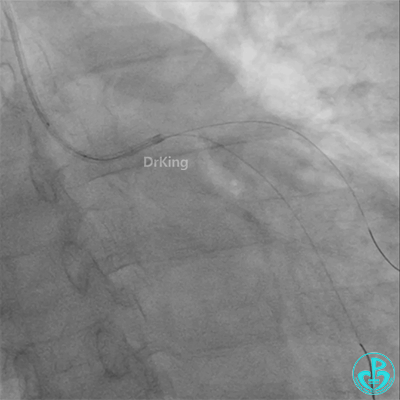
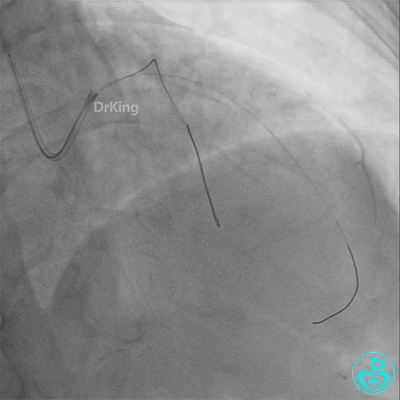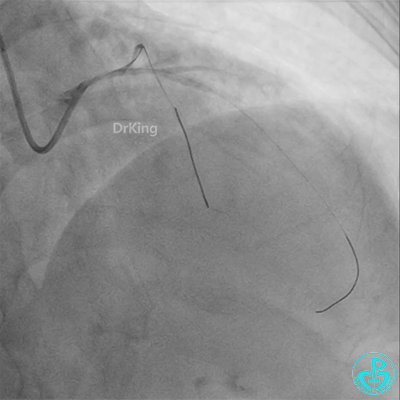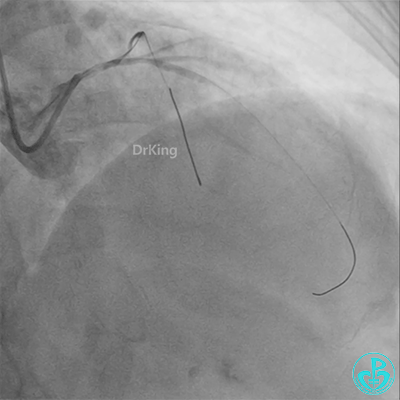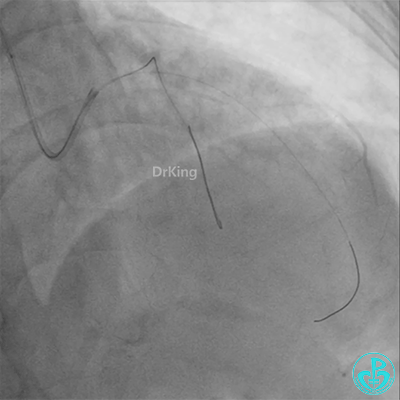
彷徨时刻!
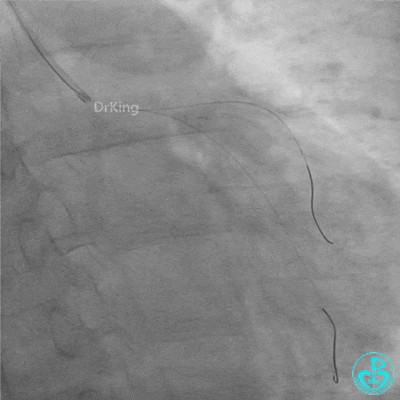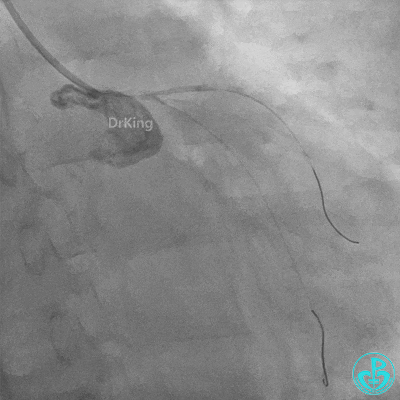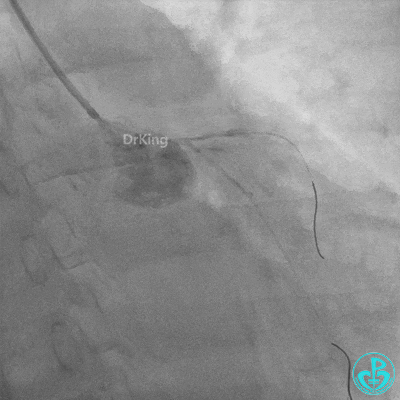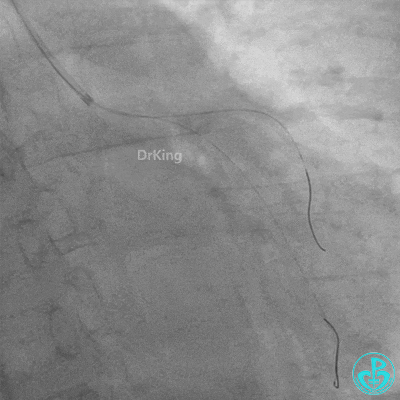
回旋支至左主干植入3.5×28mm支架。
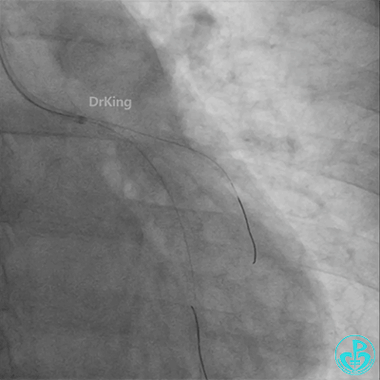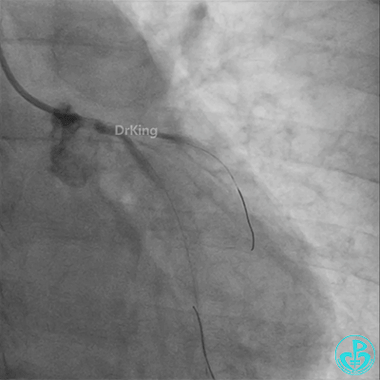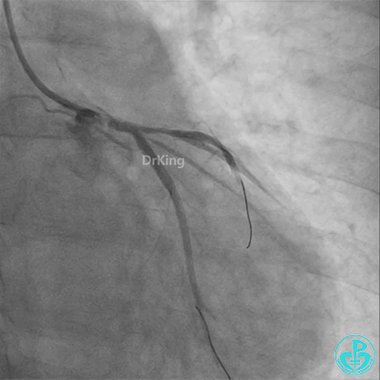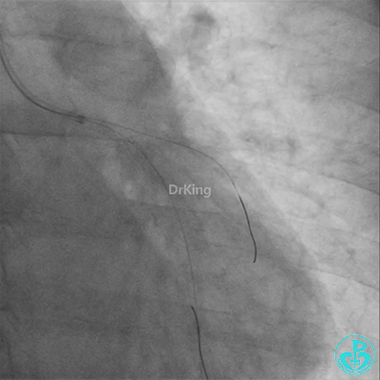
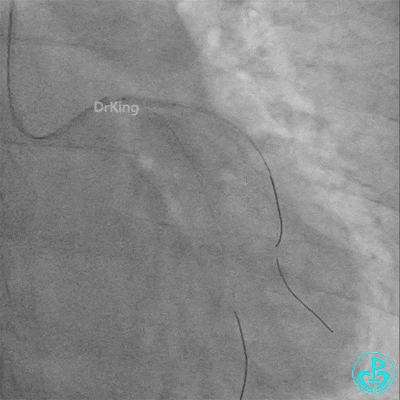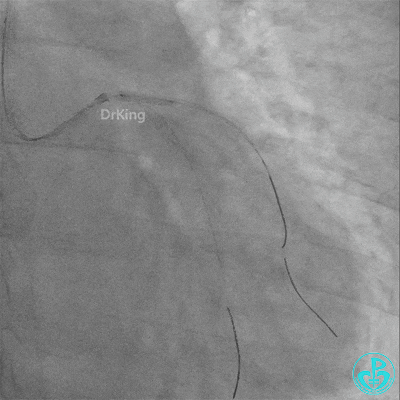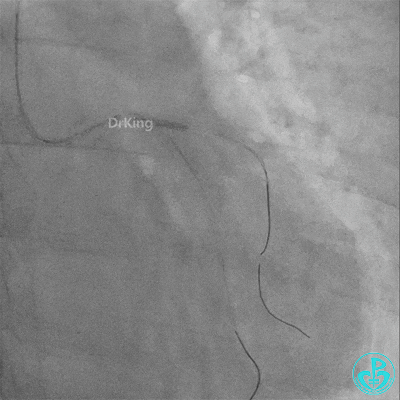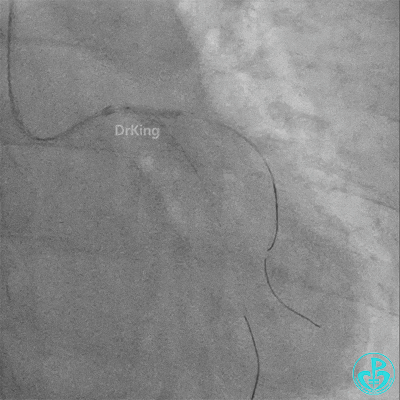
左主干导管开口处仍有血栓,疑似夹层可能。
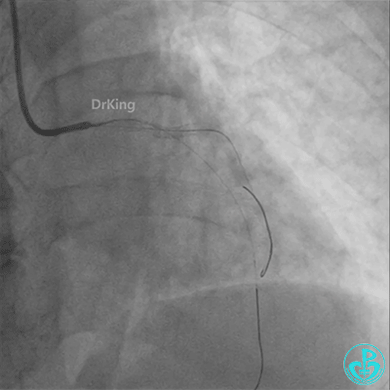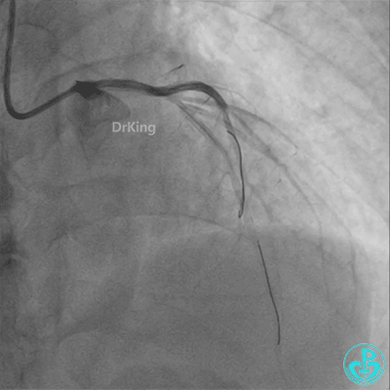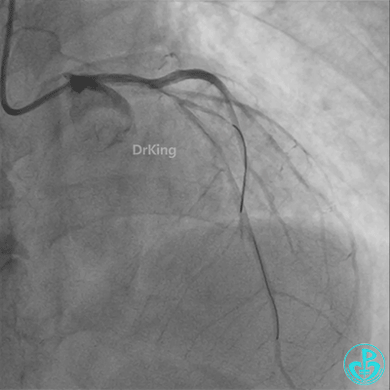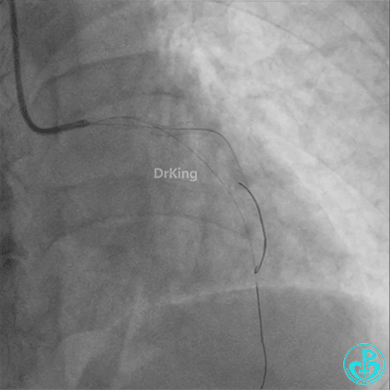
柳暗花明!
左主干植入4.0×15mm支架。
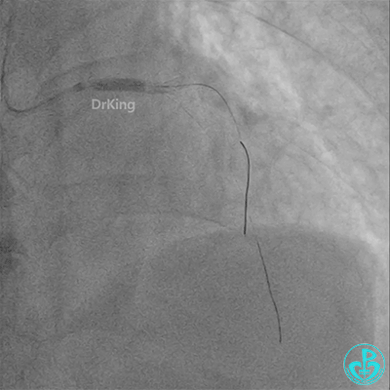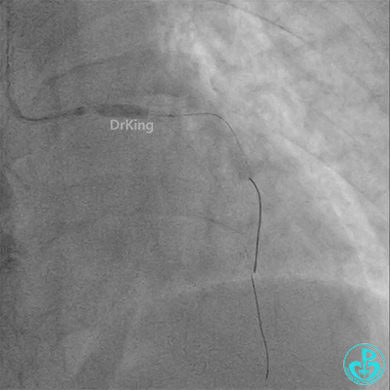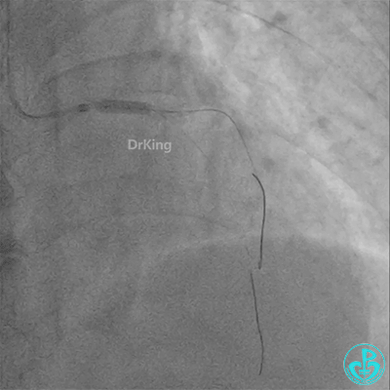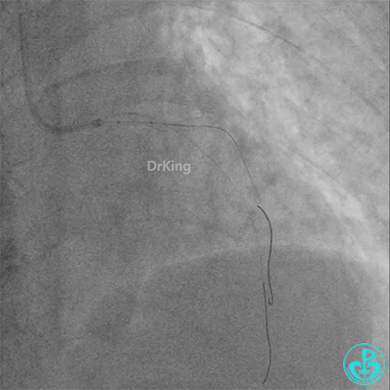
4.0×12mm非顺应耐高压扩张18atm。
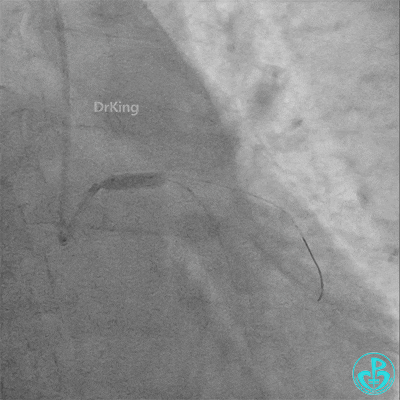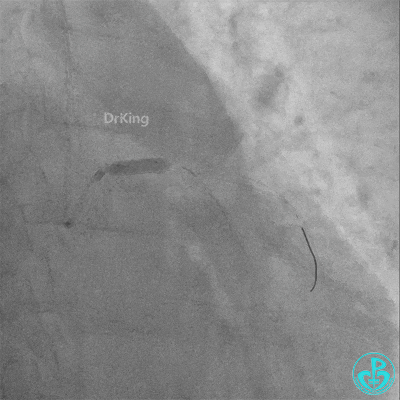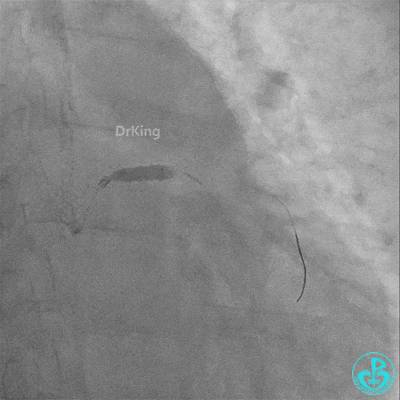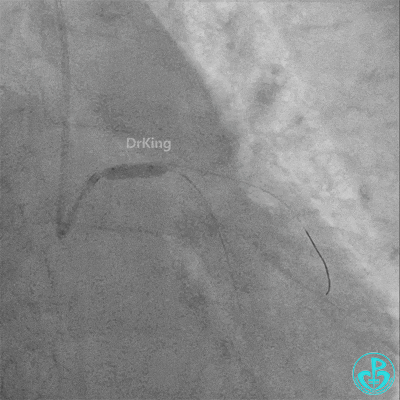
梦醒了!
重新导丝穿网眼到前降支,球囊扩张。
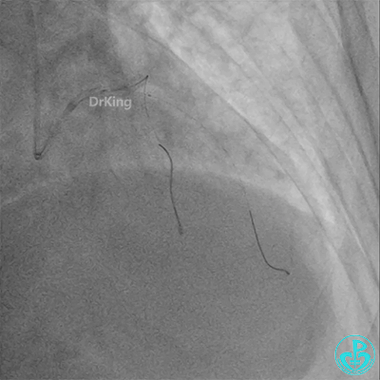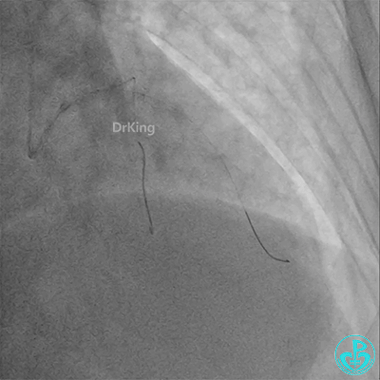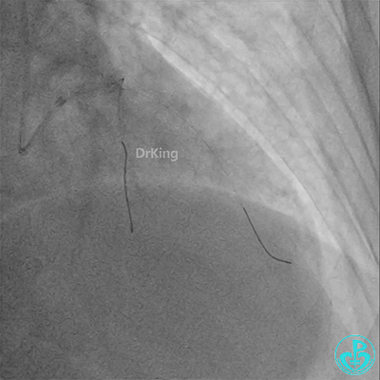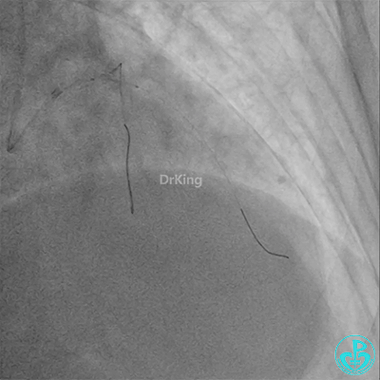
前降支3.0×25mm药物球囊扩张。
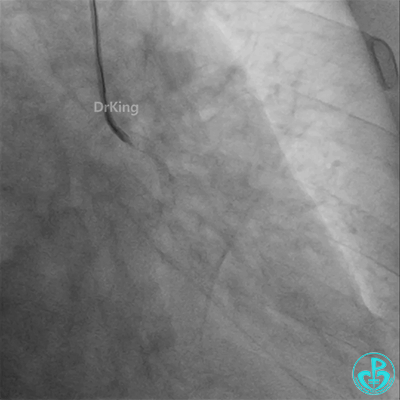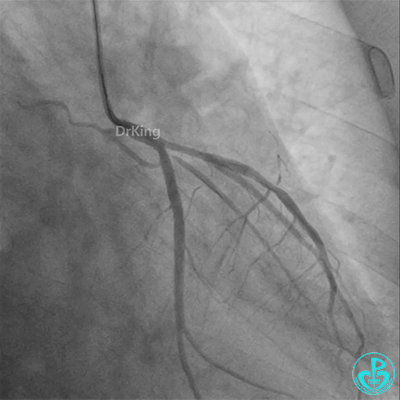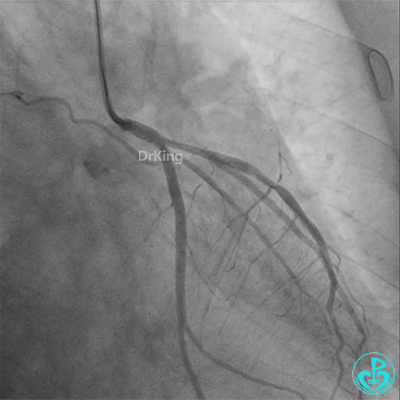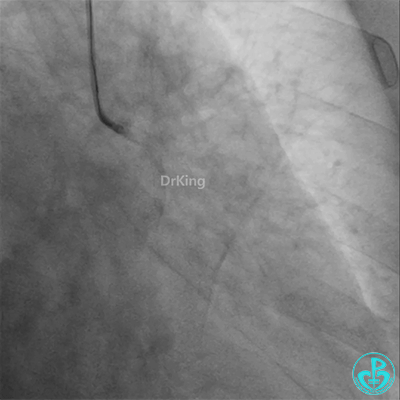
病重药亦重
术中抗凝、抗血小板、溶栓药物应用。
11:05 阿司匹林300mg,氯吡格雷600mg
11:06 肝素钠4000U iv
12:41 开始造影,肝素3000U
12:52 治疗前追加肝素3000U
发现血栓时,再次追加肝素3000U,替罗非班10ml iv
导丝再次通过,冠脉内替罗非班20ml注射,比伐芦定20ml冠脉内注射,重组人TNK纤溶酶原激活剂8mg冠脉内溶栓。
比伐芦定10ml iv,比伐芦定(0.25g+NS 50ml)微泵50ml/h应用。

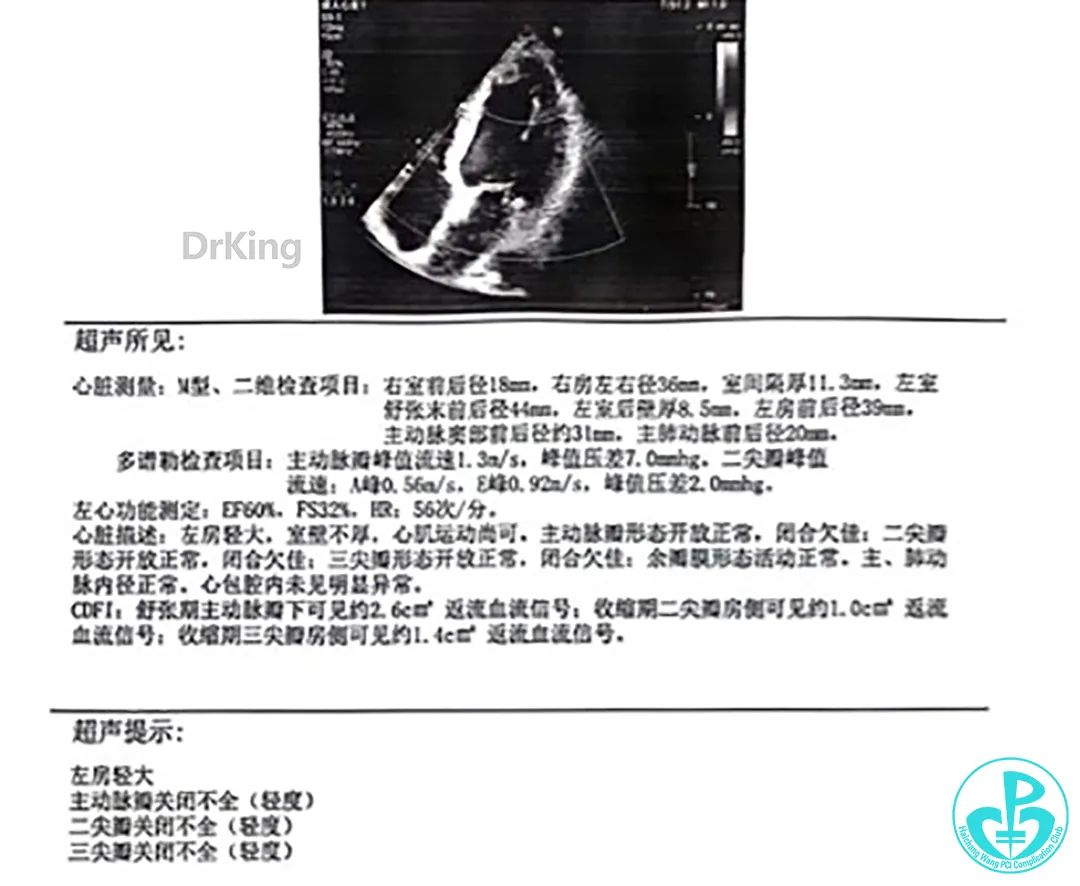
总结
一
肝素抵抗定义
肝素剂量达500U/kg时,活化凝血时间(activated clotting time,ACT)仍小于480s。目前临床上通常将需要很大剂量肝素才能达到抗凝治疗目标范围,或UFH给药量增加后APTT并未相应延长等现象概括为肝素抵抗。
目前常更换为直接凝血酶抑制剂(direct thrombin inhibitors,DTI),如比伐芦定及阿加曲班。DTI不依赖AT而直接抑制凝血酶活性,且不激活血小板,无免疫原性,半衰期短,给药后血药浓度相对稳定,常用于重症患者。
二
肝素抵抗的发生机制
根据发生机制可以将肝素抵抗分为AT介导和非AT介导两类。
(一)AT介导的肝素抵抗
AT是血浆中重要的生理性抗凝血蛋白,通过拮抗凝血酶(因子Ⅱa)以及因子IXa、Xa、XIa、XⅡa产生抗凝作用,在遗传性AT缺乏时,AT活性可降至健康人水平的40%~60%甚至更低,并导致静脉血栓栓塞症(venous thromboembolism,VTE)的风险增加。此外,作为肝素类药物的靶点,AT的抗凝效应可被肝素增强1000倍。当血浆中AT存在遗传性缺陷时(表现为活性和/或水平减低),肝素抗凝疗效往往无法达到预期,因此AT缺乏是导致肝素抵抗的主要原因。
(二)非AT介导的肝素抵抗
肝素分子携带强负电荷,可与多种生物分子结合,包括凝血途径中的多种蛋白(如因子Ⅷ、因子Xa、纤维蛋白原、组织因子途径抑制剂、血管性血友病因子等)、趋化因子(如白细胞介素-8、血小板因子4、肿瘤坏死因子-α等)、富含组氨酸的糖蛋白、脂蛋白、核蛋白、细胞外基质蛋白等;普通肝素由于糖链长,易与上述物质结合,导致半衰期缩短,清除率增加,生物利用率降低。因此在脓毒症、全身性炎性反应、热烧伤等多种疾病时,肝素抵抗的发生率往往明显增高。
三
肝素抵抗分类
(一)肝素诱导的血小板减少症(heparin induced thrombocytopenia,HIT)
HIT是一种特殊类型的肝素抵抗,多发生于使用肝素后第5~10天,其发生机制主要涉及肝素激活血小板释放血小板第4因子(platelet factor 4,PF4)并与肝素结合形成PF4-肝素复合物(PF4-H),经血中免疫细胞吞噬PF4-H后产生应答,释放抗PF4-H抗体(主要为IgG)。抗PF4-H抗体与PF4-H 结合形成IgG-PF4-H复合物,进而与血小板表面特异性IgG受体(FcγⅡA)结合,导致血小板的强烈活化和聚集。同时抗PF4-H抗体刺激单核细胞高度表达组织因子,激活凝血系统形成高凝状态。急性HIT确诊后需立即停用肝素类药物,更换为替代药物(如阿加曲班、比伐芦定等)。HIT是一种由自身抗体介导的肝素副作用,临床表现为血小板减少和进行性高凝状态,如临床未能及时识别,患者血液促凝趋势则进一步增强,使得原有血栓负荷加重或发生更严重的血栓事件。
(二)重症感染
在重症感染如败血症中,免疫效应细胞激活后释放急性相反应蛋白,肝素进入血液后可与多种血浆蛋白、内皮细胞和巨噬细胞表面受体结合并被灭活,故常见肝素抵抗现象。
(三)接受体外循环或ECMO治疗
在接受ECMO治疗的患者中,有50%的患者曾出现肝素抵抗(定义为单日肝素需要量≥35000U),但与血栓形成、出血事件及总生存率无关联。在接受体外循环的患者中,根据不同定义,肝素抵抗的发生率为4%~26%,合并感染性心内膜炎、低蛋白血症可能是此类患者发生肝素抵抗的危险因素。


