Front Immunol:不同细胞死亡途径的交互作用对系统性红斑狼疮相关心脏损伤的影响
时间:2024-10-21 18:01:16 热度:37.1℃ 作者:网络
系统性红斑狼疮(SLE)是一种多系统受累的自身免疫性疾病,其发病机制复杂,易导致多器官损伤,尤其是心血管系统。心血管疾病是SLE患者的主要死亡原因,心脏并发症的风险是普通人群的3倍。尽管医学技术的发展提高了SLE患者的生存率,但其标准化死亡率仍为普通人群的2.5倍。因此,探索SLE患者心脏受累的潜在机制是减少其死亡率的关键。近年来,研究发现程序性细胞死亡(PCD)信号,尤其是细胞凋亡、坏死性凋亡、焦亡和铁死亡,在SLE的发病过程中发挥重要作用。本文旨在探讨不同细胞死亡途径的交互作用及其对SLE心脏受累的贡献,以期为新的治疗干预提供理论依据。

本研究采用综述的方式,系统探讨了不同形式的细胞死亡途径及其交互作用在SLE心脏损伤中的作用。我们重点讨论了凋亡、坏死性凋亡、焦亡、铁死亡及中性粒细胞胞外陷阱(NETosis)之间的相互作用,并对相关临床研究进行分析。表1总结了与细胞死亡机制相关的临床试验,涵盖了干扰素-1受体阻断抗体、NLRP3炎症小体抑制剂和髓过氧化物酶(MPO)抑制剂在SLE及心血管疾病中的应用。此外,我们通过分析细胞死亡信号通路在SLE患者心血管疾病发生发展中的作用,揭示其潜在的共同靶点,并总结了各类细胞死亡途径对免疫失调及心血管损伤的贡献。
分析结果表明,凋亡在SLE患者心脏受累中起关键作用,研究显示SLE患者心脏受累伴随细胞凋亡水平显著升高,且细胞凋亡过程中未能有效清除的胞外囊泡会引发自身免疫反应。特别是通过cGAS-STING通路激活I型干扰素(IFN-1)产生,进一步加剧炎症和心血管损伤。坏死性凋亡通过RIPK1/RIPK3/MLKL通路介导炎症和免疫反应,与SLE患者心血管损伤密切相关。焦亡通过GSDMD介导,激活NLRP3炎症小体,促使IL-1β和IL-18的分泌,从而加重SLE的心脏受累。此外,NETosis在SLE患者血液中的水平显著升高,促发动脉粥样硬化和血栓形成。铁死亡则通过调节铁代谢及脂质过氧化作用,加剧心肌缺血再灌注损伤。临床研究显示,干扰素-1受体阻断抗体Anifrolumab和NETosis抑制剂MPO抑制剂等在降低SLE心血管损伤方面具有潜力。综上所述,不同细胞死亡途径的相互作用是SLE患者心血管损伤的重要机制。
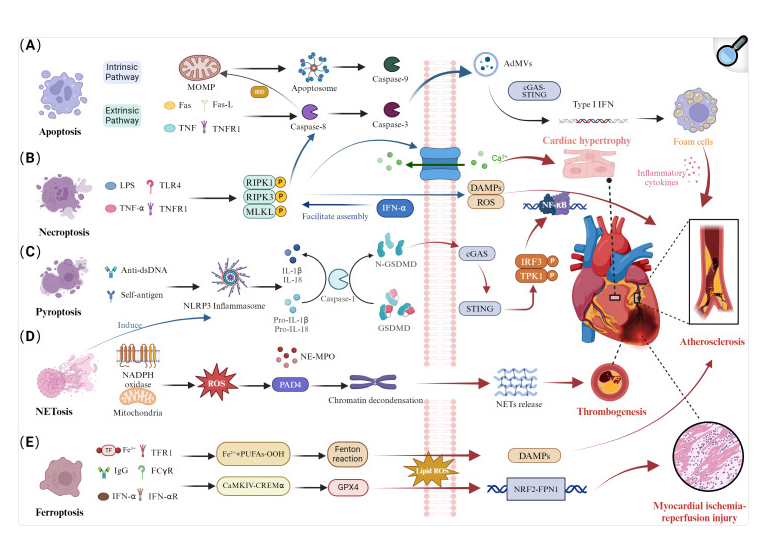
SLE中细胞死亡途径的失调和心脏受累
本研究详细探讨了几种细胞死亡途径(如凋亡、坏死性凋亡、焦亡、NETosis和铁死亡)在系统性红斑狼疮(SLE)患者心脏损伤中的作用。这些细胞死亡形式通过复杂的相互作用,导致免疫系统异常,进而损伤心脏和血管。研究发现,SLE患者的心血管疾病风险显著增加,主要与这些细胞死亡过程的异常激活有关。通过阻断这些途径中的关键信号分子(如干扰素、炎症小体等),有望减少SLE患者的心血管损伤。未来的研究应继续深入探索这些机制,以开发更有效的治疗方法,从而降低SLE患者的心血管疾病风险,并改善他们的生活质量。


