论著|重症肌无力患者肠道菌群及其代谢产物的变化
时间:2024-10-21 18:01:26 热度:37.1℃ 作者:网络
摘 要
目的 探讨重症肌无力(myasthenia gravis, MG)患者肠道菌群及其代谢产物的变化。
方法 收集MG患者及健康对照者的新鲜粪便标本,使用16S rRNA基因测序测定两组肠道菌群的丰度,并使用气相色谱质谱技术测定代谢产物的水平。收集受试者的临床特征,包括MG定量评分(quantitative MG score, QMGS)、MG日常生活活动能力量表(MG-activities of daily living, MG-ADL)评分、15项MG生活质量量表(MG-specific quality-of-life 15, MG-QOL-15)评分、徒手肌力评定量表(manual muscle testing, MMT)评分及乙酰胆碱受体抗体滴度水平,对差异菌群与临床特征的相关性进行分析。
结果 研究共收集50例MG患者及15名健康对照者。MG组Simpson指数(0.936±0.041)高于对照组(0.888±0.123),即MG组Alpha多样性降低,差异有统计学意义(t=2.349, P=0.022),且两组的微生物表型即Beta多样性存在差异(R=0.966, P=0.001, Adonis)。LEfSe结果提示MG组中志贺氏杆菌、琥珀酸弧菌属、梭杆菌属、瘤胃球菌属富集,而丰度降低的有毛螺菌属、罗氏菌属、脱硫弧菌属、粪球菌属。两组菌群的代谢产物不同,其中MG组有28种上调及71种下调代谢产物。京都基因与基因组百科全书功能聚类分析显示差异代谢产物主要参与代谢途径为氨基酸代谢、核苷酸代谢途径。MG患者肠道微生物61.2%(30/49)的扩增子序列(amplicon sequence variant, ASV)与多种代谢产物相关(P<0.001)。毛螺菌科与患者QMGS(r=-0.496, P<0.001)、MG-ADL评分(r=-0.542, P<0.001)、MG-QOL15评分(r=-0.464, P=0.007)、乙酰胆碱受体抗体滴度(r=-0.315, P=0.026)呈负相关,与MMT评分(r=0.374, P=0.008)呈正相关。
结论 MG患者肠道菌群存在有益菌丰度下调,有害菌丰度上调的情况,亦存在代谢产物紊乱,且差异ASV与MG肌无力严重程度具有负相关。
关键词
重症肌无力;肠道菌群;代谢产物;16S;rRNA;多样性;气相色谱质谱技术;相关性
重症肌无力(myasthenia gravis, MG)是一种罕见的神经系统自身免疫性疾病[1-2],长期激素或免疫抑制剂治疗增加了并发症发生的风险,且仍有部分难治性MG对现有治疗手段不敏感,从而反复出现肌无力危象危及生命[3]。目前多项研究证实肠道菌群与自身免疫密切相关[4-5]。肠道菌群较高的α多样性体现了宿主良好的健康状态[6]。既往研究提示MG患者肠道菌群的多样性异质性较大,且不同研究发现的紊乱菌群亦不相同。菌群的代谢组学联合肠道微生物分析可更好地探究疾病可能的发病机制[7]。有研究发现MG患者肠道菌群代谢产物短链脂肪酸(short chain fatty acid, SCFA)含量显著下降,从而促进MG的发病[8],但亦有研究并未发现上述变化[9]。由于MG患者肠道菌群及其代谢产物研究结果差异性较大,且我国西北地区尚无相关研究,本研究用16S rRNA及气相色谱质谱技术检测MG患者的肠道菌群及其代谢产物,期望为研究MG发病机制寻找新线索。
1 对象与方法
1.1 研究对象 本研究为横断面研究。纳入2021年9月至2024年3月中国人民解放军联勤保障部队第九四〇医院神经内科住院的MG患者,于同期招募健康对照者。MG组纳入标准:①MG的诊断符合《中国重症肌无力诊断和治疗指南(2020版)》的诊断标准[10],并且血清抗乙酰胆碱受体抗体(acetylcholine receptor antibody, AchR-Ab)阳性;②年龄≥3岁。MG组排除标准:①合并恶性肿瘤者;②合并严重心血管、呼吸、血液、神经、泌尿系统等疾病者;③合并消化系统疾病或其他需干预的自身免疫性疾病者;④近3个月使用抗生素、益生菌、益生元等药物;⑤妊娠、哺乳期女性。对照组纳入标准:①性别、年龄与MG组相匹配;②体检报告无心血管、呼吸、血液、消化、神经、泌尿系统等疾病,血生化、常规均正常。对照组排除标准:①近3个月使用抗生素、益生菌、益生元等药物;②妊娠、哺乳期女性。本研究获得医院伦理审查批准(审批编号:2022KYLL192)。研究对象均签署知情同意书。
1.2 研究方法
1.2.1 资料收集 收集受试者的性别、年龄、体质指数(body mass index, BMI)、吸烟饮酒史等资料。MG组同时收集发病年龄、胸腺情况、临床亚型。对患者采用MG定量评分(quantitative MG score, QMGS)、MG日常生活活动能力量表(MG-activities of daily living, MG-ADL)、15项MG生活质量量表(MG-specific quality-of-life 15, MG-QOL15)、徒手肌力评定量表(manual muscle testing, MMT)进行临床评分,以反映MG患者的肌无力严重程度。量表评估均由2位神经内科医师独立完成。另外,检测每例患者外周血乙酰胆碱受体抗体滴度水平。
1.2.2 粪便标本收集 予每位受试者无菌无酶粪便采集管,嘱收集清晨新鲜粪便10 g,用无菌勺取粪便内部,尽量避免尿液、马桶壁对样本的污染,采集后迅速置于-80 ℃冰箱冻存,避免反复冻融。实验时将收集管保存于干冰中,超低温运至实验室。
1.2.3 生物信息分析 采用MagPure Soil DNA LQ Kit (Magan)试剂盒按照说明书提取粪便基因组DNA。将提取DNA保存于-20 ℃,以提取的基因DNA为模板,用带Barcode的特异引物和TaKaRa Ex Taq高保真酶进行细菌16S rRNA基因PCR扩增。通用引物343F(5'-TACGGRAGGCAGCAG-3')和798R(5'-AGGGTATCTAATCCT-3')扩增V3~V4可变区,用于细菌多样性分析。用气相色谱质谱技术进行粪便代谢组学分析,流程为样本预处理、代谢物提取、代谢物衍生化及质谱检测。
1.3 统计学方法 使用GraphPad Prism 9.0进行统计分析。年龄、BMI符合正态分布,组间比较用独立样本t检验。性别、饮酒吸烟史组间比较用χ2检验。用QIIME 2软件进行Alpha(α)和Beta(β)多样性分析。α多样性包括基于丰度的覆盖度估计值(abundance-based coverage estimator,ACE),以及Chao1、Shannon和Simpson指数。利用binary Jaccard距离矩阵表示β多样性,组间差异用Adonis检验,并用主坐标分析(principal coordinates analysis, PCoA)可视化β多样性。应用LEfSe中线性判别分析(linear discriminant analysis,LDA)有效筛选两组的差异菌群,该方法是基于Wilcoxon秩和检验分析组间差异菌属,并计算出不同菌属的效应值LDA大小,筛选条件LDA≥2.0且P<0.05。肠道菌群代谢产物的代谢组学分析采用正交偏最小二乘判别分析(OPLS-DA),变量权重值(variable important in projection, VIP)>1则两组样本代谢产物不同,再进行t检验得两组间具有统计学差异的代谢产物。用京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)对差异代谢物进行富集分析,并用气泡图展示。将两组差异微生物、代谢物与临床指标进行Spearman相关性分析并制作热图。检验水准α=0.05。
2 结果
2.1 一般资料 共招募65例受试者,其中MG患者50例,对照者15名。MG组与对照组在年龄(t=0.616, P=0.540)、性别(χ2=0.002, P=0.962)、BMI(t=0.959, P=0.341)、饮酒(χ2=1.287, P=0.257)、吸烟(χ2=0.014, P=0.907)方面无统计学差异,见表1。MG组发病年龄为(47.78±19.80)岁;合并胸腺瘤者13例,占26%;眼肌型MG(ocular MG, OMG)与全身型MG(generalized MG, GMG)各25例,各占50%;早发型患者25例,占50%;MG组的QMGS为(4.84±4.22)分。
Tab.1 The general data of MG patients and healthy controls表1 MG组和对照组一般资料
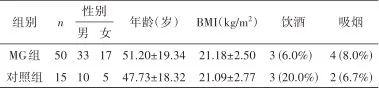
注:MG,重症肌无力;BMI,体质指数。
2.2 肠道菌群
2.2.1 肠道菌群多样性分析 肠道菌群α多样性分析提示两组的ACE指数(t=0.578, P=0.566)、Chao1指数(t=0.547, P=0.586)、Shannon指数(t=1.599, P=0.115)差异无统计学意义,而MG组的Simpson指数(0.936±0.041)高于对照组(0.888±0.123),即MG组多样性低于对照组,差异有统计学意义(t=2.349, P=0.022)(图1A)。PCoA分析提示,两组的β多样性binary Jaccard距离差异有统计学意义(R=0.966, P=0.001, Adonis)(图1B)。另外,OMG与GMG患者的ACE指数(t=0.052, P=0.959)、Chao1指数(t=0.054, P=0.957)、Shannon指数(t=0.667, P=0.508)、Simpson指数(t=1.248, P=0.218)差异无统计学意义,而OMG与GMG患者的β多样性binary Jaccard距离差异有统计学意义(R=0.970, P=0.001, Adonis)。
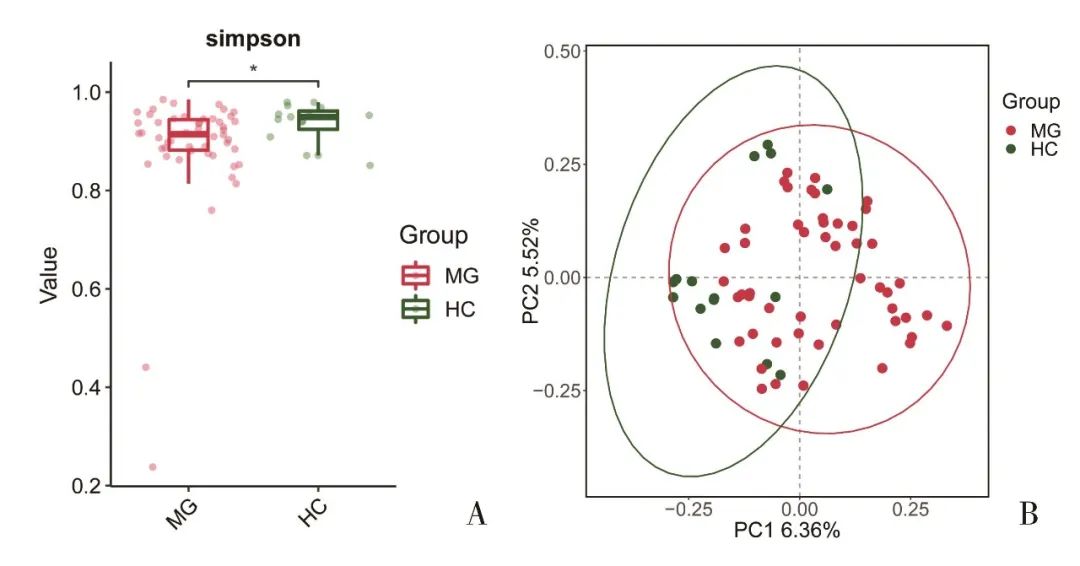
Fig.1 The difference in Simpson index (P=0.022, A) and the beta diversity (P=0.001, B) between the MG group and the HC group was significant图1 MG组与对照组的Simpson指数(P=0.022,图A)及β多样性(P=0.001,图B)差异有统计学意义 注:MG,重症肌无力患者组;HC,对照组。
2.2.2 肠道菌群差异分析 门水平,两组优势菌为拟杆菌门、厚壁菌门、放线菌门、变形菌门(图2)。MG组厚壁菌门/拟杆菌门(F/B)比例低于对照组(1.04 vs. 1.07)(图2A)。属水平两组优势菌为拟杆菌属、粪杆菌属、普雷沃氏菌属、志贺氏杆菌属(图2B)。
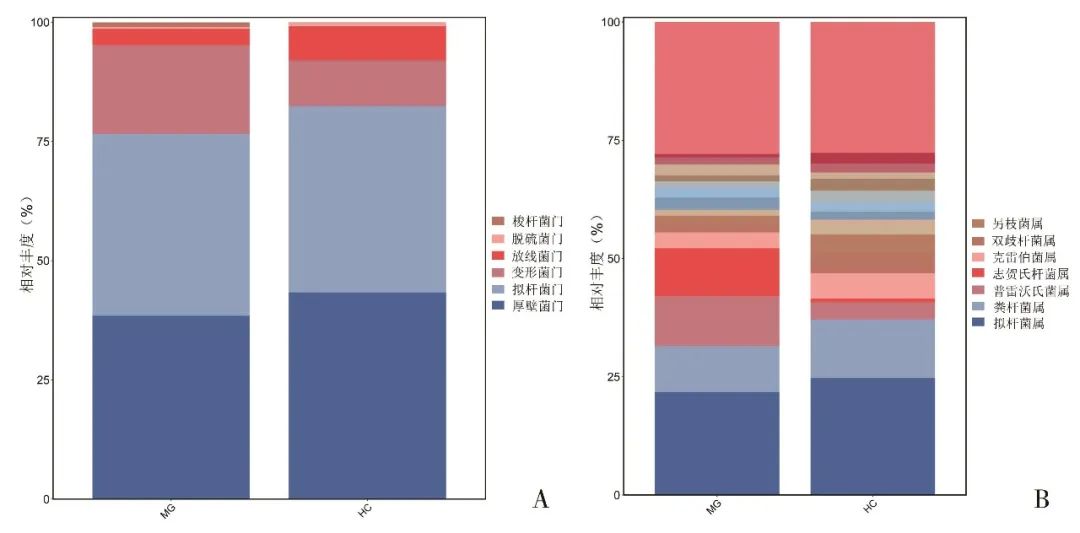
Fig.2 Categorical summary of dominant intestine flora of the MG group and the HC group at the level of phylum (A) and genus (B)图2 MG组和对照组在门水平(A)、属水平(B)优势菌群的物种累积柱状图 注:MG,重症肌无力患者组;HC,对照组。
LEfSe分析示MG组属水平富集的菌群有志贺氏杆菌属(LDA=4.649, P=0.009)、琥珀酸弧菌属(LDA=3.966, P=0.029)、梭杆菌属(LDA=3.645, P=0.001)、瘤胃球菌属(LDA=3.538, P=0.004);而对照组属水平富集的有毛螺菌属(LDA=3.787, P=0.002)、罗氏菌属(LDA=3.666, P=0.027)、脱硫弧菌属(LDA=3.380, P=0.008)、粪球菌属(LDA=3.355, P=0.039)。见图3。
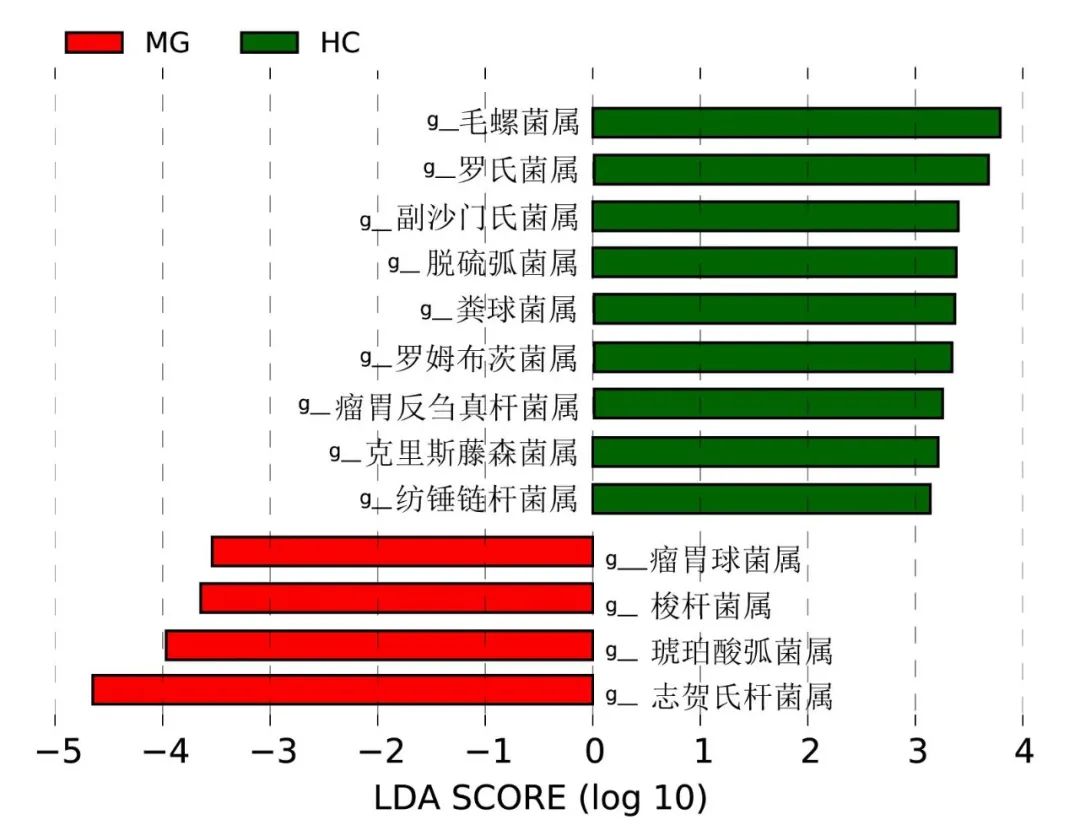
Fig.3 Column plot of linear discriminant analysis (LDA) scores calculated according to differential enriched genera between the of MG group and the HC group图3 MG组与对照组间差异菌属线性判别分析(LDA)得分列线图 注:MG,重症肌无力患者组;HC,对照组;g,属水平。
2.3 MG组与对照组差异代谢产物参与的代谢途径 OPLS-DA结果示两组肠道菌群代谢产物[R2X(cum)=0.329,R2Y(cum)=0.957,Q2(cum)=0.795]不同(图4A)。与对照组相比,MG组有28种上调(P<0.05,VIP>1,logFC>0)及71种下调(P<0.05,VIP>1,logFC<0)的代谢产物(图4B)。KEGG分析显示差异代谢产物参与的代谢途径主要为氨基酸和核苷酸代谢、D-氨基酸代谢、半乳糖代谢、赖氨酸退化、嘌呤代谢、氨酰生物合成、蛋白质的消化和吸收、谷胱甘肽代谢(图4C)。
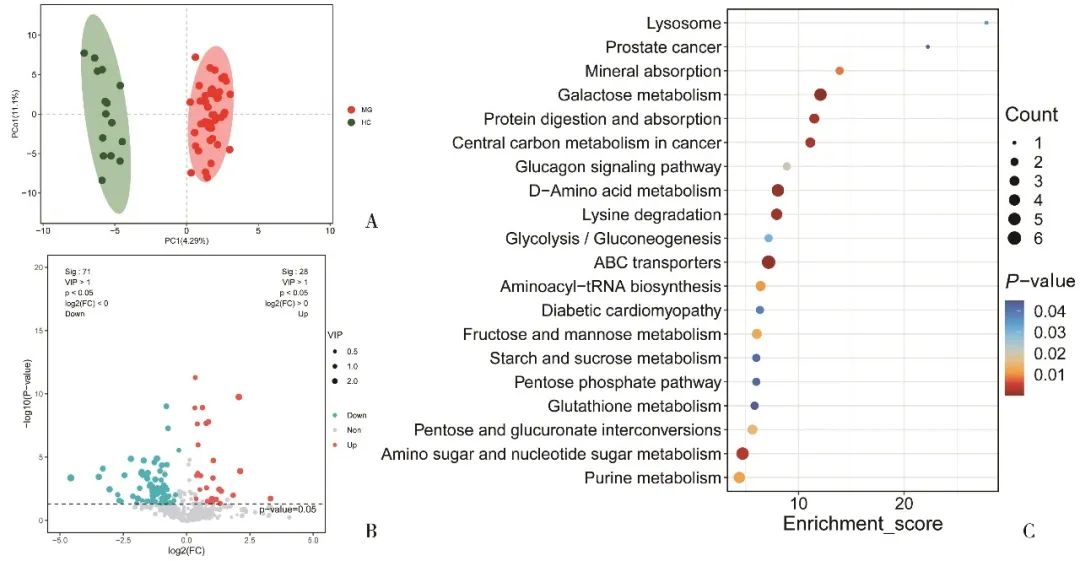
Fig.4 OPLS-DA score plots demonstrated that there was a obvious difference between the group of MG and HC (A). Illustration of selected discrepancy metabolites using discrepancy metabolite volcano maps (B). Presentation of differential metabolic pathways by KEGG (C)图4 MG组和对照组代谢产物的OPLS-DA分析(A);火山图可视化MG组上调(红)和下调(蓝)的产物(B);KEGG展示差异代谢产物参与的通路(C) 注:MG,重症肌无力患者组;HC,对照组。C图中,圆大小为所涉及的代谢途径的量,红色为上调、蓝色为下调的代谢物。
2.4 MG患者肠道菌群与代谢产物及临床指标的相关性分析 肠道微生物61.2%(30/49)的细菌扩增子序列(amplicon sequence variant, ASV)与多种代谢产物相关(|r|>0.55,P<0.001)。上述ASV主要属于乳酸菌科(8个ASV)、毛螺菌科(12个ASV)、普雷沃氏菌科(1个ASV)。此外,毛螺菌科(ASV105)与患者QMGS(r=-0.496, P<0.001)、MG-ADL评分(r=-0.542, P<0.001)、MG-QOL15评分(r=-0.464, P=0.007)、AchR-Ab滴度(r=-0.315, P=0.026)呈负相关,与MMT评分(r=0.374, P=0.008)呈正相关。见图5。
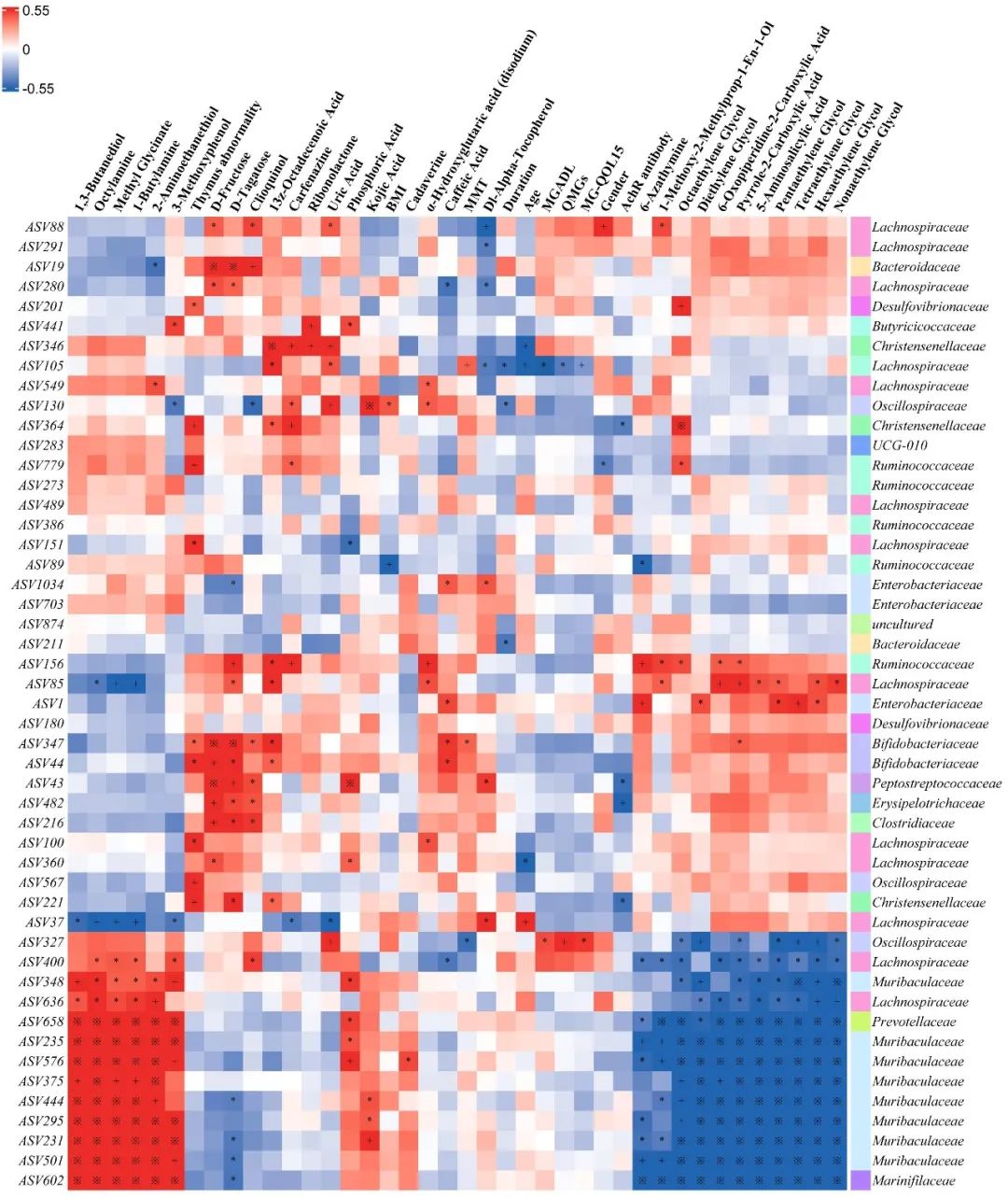
Fig.5 Heat map of Spearman rank correlation between gut microbial ASV and metabolites and clinical indicators图5 肠道微生物ASV与代谢产物和临床指标的Spearman相关热图 注:红色为正相关,蓝色为负相关。*P<0.05;+P<0.01;※P<0.001。MMT,徒手肌力评定量表;MG-ADL,MG日常生活活动能力量表;QMGS,MG定量评分;MG-QOL15,15项MG生活质量量表;AchR-Ab,乙酰胆碱受体抗体。Lachnospiraceae,毛螺菌科;Prevotellaceae,普雷沃氏菌科。
3 讨论
正常宿主肠道菌群的多样性较高,微生物间及其与宿主间保持互利共生、平衡协调的关系,而一旦稳态被破坏,微生物多样性大幅下降,潜在致病性菌群入侵宿主肠道黏膜,从而引起炎症反应[11]。本研究结果提示MG患者肠道菌群α多样性下降且微生物表型与对照组不同,与部分既往研究结果一致[12]。虽然本研究肠道菌群的α多样性未因疾病亚型不同而出现不同,但是β多样性表现出差异,即OMG与GMG的微生物表型不同,与TAN等[13]研究部分结果一致。此外,F/B比值降低在诸如系统性红斑狼疮[14]、多发性硬化症[15]等多种自身免疫性疾病中可观察到,同样本研究也发现这一现象。STOJANOV等[16]研究发现F/B比值降低可破坏肠道上皮细胞,加剧炎症反应。
SELLGE等[17]建立了小鼠感染模型,发现志贺菌主要诱导T辅助细胞17(T helper cells 17, Tp7),Tp7细胞主要产生白细胞介素17A(interleukin 17A, IL-17A)。而Tp7细胞及其分泌的细胞因子在MG患者中含量较高,促进疾病的发生发展[18]。ZHAO等[19]亦发现MG组志贺氏杆菌富集,且其丰度与炎症因子和抗体呈正相关,MG患者口服中药制剂后,志贺氏杆菌属丰度下调至对照组水平。集中在肠道相关淋巴组织Peyer’s斑附近的M细胞,可以高度特异性吞噬微生物抗原,将其递送到抗原提呈细胞(antigen-presenting cell, APC),即巨噬细胞和树突状细胞,而APC也可直接摄取细菌抗原产生抗炎作用。与既往文献一致的是,本研究结果亦提示MG组志贺氏杆菌属丰度上调,罗氏菌属丰度下调。志贺氏杆菌可经M细胞穿过肠上皮,诱导巨噬细胞吞噬,导致巨噬细胞死亡并与上皮基底外侧表面相互作用,从而引起一系列炎症反应。除了发现MG组志贺氏杆菌属丰度上调,罗氏菌属丰度下调,本研究还发现瘤胃球菌属丰度上调,而毛螺菌属丰度下调,这种有害菌增加而有益菌减少的环境,可导致肠道黏膜通透性增加及Foxp3+CD4+和Tp7细胞比例失衡。Foxp3+CD4+细胞是一组能调节免疫耐受及预防自身免疫性疾病的调节性T淋巴细胞,在MG患者中表达下降可诱导AchR抗体的产生,从而参与MG发生发展[20]。
本研究发现MG组肠道菌群差异代谢产物注释到氨基酸代谢、嘌呤代谢、核苷酸代谢途径的产物最多。这一定程度上与ZHENG等[21]研究一致,该研究发现MG患者肠道菌群代谢产物主要参与的代谢通路为氨基酸代谢和核苷酸代谢。CUI等[22]证实血清氨基酸水平的变化可以反映自身免疫性疾病患者膝关节骨关节炎的存在,而氨基酸含量超过正常水平对MG发病机制的影响目前尚无相关研究。既往研究也报道了MG患者中存在蛋白质水平抗氧化应激状态的改变[23-24]。所以核苷酸代谢领域在MG患者中的作用值得进一步研究。
本研究发现肠道菌群ASV与患者临床特征有相关性。毛螺菌科(Lachnospiraceae)与QMGS、MG-ADL评分、MG-QOL15评分、AchR-Ab滴度呈负相关,与MMT评分呈正相关,即毛螺菌科与疾病严重程度呈负相关。在有腹泻、便血、体质量减轻症状及组织病理提示有肠黏膜损伤的溃疡性结肠炎小鼠模型中发现,中药八宝丹可减轻上述症状,抑制促炎细胞因子(IL-6、IL-1β、IFN-γ、TNF-α)的分泌,上调CD3+T细胞比例和CD4+/CD8+比值,且使得丰度降低的毛螺菌科丰度上调[25]。这可提示毛螺菌科在自身免疫性疾病中发挥重要作用,其可能通过调节免疫机制影响疾病的发生发展。另外,关于AchR-Ab滴度与疾病严重程度之间的相关性尚存在争议[26-27]。在本研究中,AchR-Ab滴度与疾病严重程度(QMGS)呈正相关(r=0.382,P=0.006),且毛螺菌科与AchR-Ab滴度呈负相关。肠道本身属于一个复杂的生态平衡系统,其受诸多因素影响,在外界因素干扰下,肠道菌群可出现瞬时性变化导致菌群紊乱[28]。本研究在我国西北地区开展,西北地区具有较特殊的环境,海拔相对较高、日照时间较长,高海拔菌群变化也是今后研究的方向之一。
本研究存在一定局限性:第一,样本量较小;第二,横断面研究不能解释疾病与微生物间的因果关联;第三,未行动物实验进行验证。因此未来需开展多中心研究以深入分析MG患者肠道菌群及代谢产物的变化,揭示MG发病机制,为治疗提供新思路。
参考文献:
1. DRESSER L, WLODARSKI R, REZANIA K, et al. Myasthenia gravis: Epidemiology, pathophysiology and clinical manifestations[J]. J Clin Med, 2021, 10(11): 2235.
2. PUNGA A R, MADDISON P, HECKMANN J M, et al. Epidemiology, diagnostics, and biomarkers of autoimmune neuromuscular junction disorders[J]. Lancet Neurol, 2022, 21(2): 176-188.
3. HARRIS L, GRAHAM S, MACLACHLAN S, et al. A retrospective longitudinal cohort study of the clinical burden in myasthenia gravis[J]. BMC Neurol, 2022, 22(1): 172.
4. HOU K, WU Z X, CHEN X Y, et al. Microbiota in health and diseases[J]. Signal Transduct Target Ther, 2022, 7(1): 135.
5. ZHENG D, LIWINSKI T, ELINAV E. Interaction between microbiota and immunity in health and disease[J]. Cell Res, 2020, 30(6): 492-506.
6. LEIBOVITZH H, LEE S H, XUE M, et al. Altered gut microbiome composition and function are associated with gut barrier dysfunction in healthy relatives of patients with Crohn’s disease[J]. Gastroenterology, 2022, 163(5): 1364-1376, e10.
7. STEWART C J, MANSBACH J M, WONG M C, et al. Associations of nasopharyngeal metabolome and microbiome with severity among infants with bronchiolitis. A multiomic analysis[J]. Am J Respir Crit Care Med, 2017, 196(7): 882-891.
8. LIU P, JIANG Y, GU S, et al. Metagenome-wide association study of gut microbiome revealed potential microbial marker set for diagnosis of pediatric myasthenia gravis[J]. BMC Med, 2021, 19(1): 159.
9. MORIS G, ARBOLEYA S, MANCABELLI L, et al. Fecal microbiota profile in a group of myasthenia gravis patients[J]. Sci Rep, 2018, 8(1): 14384.
10. 中国免疫学会神经免疫分会, 常婷, 李柱一, 等. 中国重症肌无力诊断和治疗指南(2020版)[J]. 中国神经免疫学和神经病学杂志, 2021, 28(1): 1-12.
11. RICCIO P, ROSSANO R. Undigested food and gut microbiota may cooperate in the pathogenesis of neuroinflammatory diseases: A matter of barriers and a proposal on the origin of organ specificity[J]. Nutrients, 2019, 11(11): 2714.
12. QIU D, XIA Z, JIAO X, et al. Altered gut microbiota in myasthenia gravis[J]. Front Microbiol, 2018, 9: 2627.
13. TAN X, HUANG Y, CHAI T, et al. Differential gut microbiota and fecal metabolites related with the clinical subtypes of myasthenia gravis[J]. Front Microbiol, 2020, 11: 564-579.
14. DE LUCA F, SHOENFELD Y. The microbiome in autoimmune diseases[J]. Clin Exp Immunol, 2019, 195(1): 74-85.
15. FANARA S, APRILE M, IACONO S, et al. The role of nutritional lifestyle and physical activity in multiple sclerosis pathogenesis and management: A narrative review[J]. Nutrients, 2021, 13(11): 3774.
16. STOJANOV S, BERLEC A, ŠTRUKELJ B. The influence of probiotics on the firmicutes/bacteroidetes ratio in the treatment of obesity and inflammatory bowel disease[J]. Microorganisms, 2020, 8(11): 1775.
17. SELLGE G, MAGALHAES J G, KONRADT C, et al. Tp7 cells are the dominant T cell subtype primed by Shigella flexneri mediating protective immunity[J]. J Immunol, 2010, 184(4): 2076-2085.
18. CEBI M, CAKAR A, ERDOGDU E, et al. Thymoma patients with or without myasthenia gravis have increased Tp7 cells, IL-17 production and ICOS expression[J]. J Neuroimmunol, 2023, 381: 578129.
19. ZHAO M, LIU L, LIU F, et al. Traditional Chinese medicine improves myasthenia gravis by regulating the symbiotic homeostasis of the intestinal microbiota and host[J]. Front Microbiol, 2022, 13: 1082565.
20. SHIN D S, JORDAN A, BASU S, et al. Regulatory T cells suppress CD4+ T cells through NFAT-dependent transcriptional mechanisms[J]. EMBO Rep, 2014, 15(9): 991-999.
21. ZHENG P, LI Y, WU J, et al. Perturbed microbial ecology in myasthenia gravis: Evidence from the gut microbiome and fecal metabolome[J]. Adv Sci (Weinh), 2019, 6(18): 1901441.
22. CUI Z Y, FENG H, HE B C, et al. Causal associations between serum amino acid levels and osteoarthritis: A Mendelian randomization study[J]. Osteoarthritis Cartilage, 2023, 31(8): 1121-1131.
23. FUHUA P, XUHUI D, ZHIYANG Z, et al. Antioxidant status of bilirubin and uric acid in patients with myasthenia gravis[J]. Neuroimmunomodulation, 2012, 19(1): 43-49.
24. YANG D, SU Z, WU S, et al. Low antioxidant status of serum bilirubin, uric acid, albumin and creatinine in patients with myasthenia gravis[J]. Int J Neurosci, 2016, 126(12): 1120-1126.
25. HUANG B, GUI M, AN H, et al. Babao Dan alleviates gut immune and microbiota disorders while impacting the TLR4/MyD88/NF-кB pathway to attenuate 5-Fluorouracil-induced intestinal injury[J]. Biomed Pharmacother, 2023, 166: 115387.
26. AGUIRRE F, MANIN A, FERNANDEZ V C, et al. C3, C5a and anti-acetylcholine receptor antibody as severity biomarkers in myasthenia gravis[J]. Ther Adv Neurol Disord, 2020, 13: 1756286420935697.
27. WANG L, WANG S, YANG H, et al. No correlation between acetylcholine receptor antibody concentration and individual clinical symptoms of myasthenia gravis: A systematic retrospective study involving 67 patients[J]. Brain Behav, 2021, 11(7): e02203.
28. SUZUKI T A, PHIFER-RIXEY M, MACK K L, et al. Host genetic determinants of the gut microbiota of wild mice[J]. Mol Ecol, 2019, 28(13): 3197-3207.
【引用格式】吴倩,李君莲,李海燕,等. 重症肌无力患者肠道菌群及其代谢产物的变化[J]. 中国神经精神疾病杂志,2024,50(6):321-324.
【Cite this article】WU Q,LI J L,LI H Y,et al. Altered gut microbiota and their metabolites in patients with myasthenia gravis[J]. Chin J Nervous Mental Dis,2024,50(6):321-324.
DOI:10.3969/j.issn.1002-0152.2024.06.002


