你没看错!晚期肺腺癌用NGS检测胸水上清的基因突变阳性率超90%,远高于胸水细胞沉淀样本
时间:2024-10-20 06:02:09 热度:37.1℃ 作者:网络
对非小细胞肺癌标本进行全面的二代测序(NGS)可以识别致癌驱动突变及其相应的靶向治疗。血浆游离DNA(cfDNA)基因分型容易进行,但是假阴性也不容忽视。研究者探索了恶性胸腔积液(MPE,富含cfDNA)作为基因分型的非劣于肿瘤组织的替代标本。研究者进行了一项前瞻性研究,包括39例有MPE的新诊断IV期肺腺癌患者。研究者将匹配热点变异(包括EGFR、ALK和ROS1)的组织检测与基于胸腔积液上清液(40mL)中cfDNA的AlphaLiquid100 panel(覆盖118个癌症相关基因的所有外显子)检测进行了比较。
在成功测序的39个PE-cfDNA样本中,32个(82.1%)的PE细胞块肿瘤含量<10%。标准组织或细胞块检测针对EGFR、ALK和ROS1发现了20个突变(51.3%),而PE cfDNA发现了25个突变(64.1%)。在PE cfDNA中观察到5个EGFR突变,但在EGFR(Cobas)检测中未观察到,原因是覆盖范围或肿瘤含量不足。在PE cfDNA中发现的总致癌性突变率为92.3%,突变分布如下:即使使用非常低的cfDNA,也可以获得较高的检出率。此外,大多数患者携带共突变。胸腔积液NGS与传统检测方法的比较揭示了准确性的差异。研究者还对有EGFR致敏突变的患者进行了随访,这些患者在3个月后的治疗应答率为97.2%。
除了血浆和肿瘤检测之外,MPE上清cfDNA的基因分型在临床实践中也是可行的,以提高诊断率并扩大患者从靶向治疗中获益。
-
使用胸腔积液沉淀物的标准细胞块检测确定EGFR(Cobas)、ALK(IHC)和ROS1(IHC)的成功率约为50%,而Alphaliquid®100靶向捕获panel在cfDNA中确定了90%以上的致癌性突变;
-
来自胸腔积液上清液的cfDNA分析是一种实用方法,可作为血浆和肿瘤检测的补充,提高了诊断准确性,并改善了患者对靶向治疗的可及性。
研究背景
近年来,病理诊断方法的进步使得基于病理学和和基因学的肺癌分类更加精确,从而改善了治疗方案。对小细胞学和活检样本获得准确诊断的重要性强调了识别非小细胞肺癌(NSCLC)特定组织学类型和分子特征的必要性。组织基因分型被认为是癌症诊断中识别人类基因组变化的金标准方法;然而,这种技术有许多局限性。该方法侵入性强、昂贵且耗时,因此对于少量肿瘤组织或癌症治疗方案的随访而言不切实际。因此,液体活检被认为是有创诊断方法的一种有前景替代方法。候选液体活检,包括循环肿瘤细胞(CTCs)、循环无细胞肿瘤DNA(cfDNA)、与肿瘤相关的血小板(TEP)和细胞外囊泡(EVs),含有癌症来源的生物分子。它们可以识别引发癌症的驱动突变、由于药物世代而产生的获得性耐药、难治性疾病、预后和监测。在癌症患者中,大多数cfDNA是通过肿瘤细胞的凋亡或坏死释放。使用cfDNA的无创诊断检测具有显著的临床潜力。cfDNA的片段化模式可以提示癌症患者的组织来源。尽管二代测序(NGS)被广泛用于肿瘤组织谱分析,但其对cfDNA应用的分析灵敏度有限。这一局限性通常是由于从cfDNA捕获或富集感兴趣的基因区域的效率,以及测序反应的较高错误率。血浆cfDNA常作为液体活检用于各种癌症的基因检测,但血浆总cfDNA中的肿瘤来源cfDNA可能含量较低。
目前,有研究正在研究使用从不同体液(包括血浆、胸腔积液(PE)、脑脊液、唾液和尿液)分离的肿瘤衍生cfDNA进行癌症基因组谱分析。晚期肺癌患者由于肿瘤细胞侵袭胸膜腔,导致胸腔积液引流受阻,血浆向胸膜腔漏出增多,从而发展为恶性胸腔积液(MPE)。PE样本可在避免额外有创采样的同时被采集,PE样本中含有漂浮的恶性细胞和在上清液中的肿瘤来源cfDNA。之前的研究已经使用从恶性胸腔积液上清中提取的cfDNA分析了EGFR突变,发现恶性胸腔积液上清对肿瘤特异性突变的检出率和敏感性显著高于含有肿瘤细胞的沉积物。诊断MPE可能具有挑战性,只有60-80%的腺癌病例有阳性细胞学检查结果。此外,在临床诊断中,胸膜穿刺细胞学阴性患者PE的可能性在很大程度上未被探索。
NCCN指南推荐的晚期NSCLC分子检测因样本量不足而未常规进行。在台湾,在国民健康保险制度下,检测PE的标准方法是分离沉淀物进行细胞块染色或聚合酶链反应(PCR),包括鉴定EGFR(Cobas), ALK(IHC)和ROS1(IHC)。然而,由于PE沉淀物中肿瘤细胞数量有限,其敏感性和准确性常受到质疑。为了比较从PE中提取的cfDNA和沉淀物中细胞块染色的基因分型,研究者在台湾的一个医学中心和三个教学医院进行了一项前瞻性研究。研究旨在确定胸膜cfDNA可否用于评估有MPE的肺腺癌患者的可作为靶点的突变。本研究是台湾NGS检测MPE临床应用的开创性研究。
研究结果
本研究包括39例IV期非小细胞肺癌患者(30.8%为男性),这些患者存在PE。诊断时的中位年龄为67.7岁(范围48 ~ 84岁),25例(64.1%)为非吸烟者。其中26例(66.7%)发生远处转移(IVB期)。39例PE cfDNA样本均成功测序。其中32例(82.1%)PE中肿瘤含量<10%。研究者分析了这些患者,其中只有18例(46.2%)能够成功进行组织活检,21例(53.8%)无法进行组织活检(表1)。
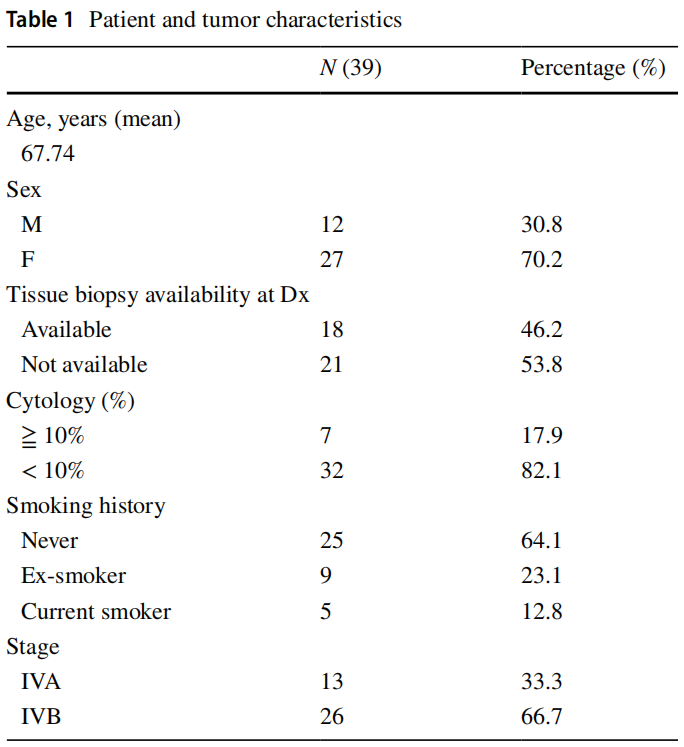
表1
通过PE沉积物的标准细胞块检测EGFR(Cobas)、ALK(IHC)和ROS1(IHC),发现了20种突变(51.3%),而AlphaLiquid 100 panel检测发现了25种突变(64.1%)。使用cfDNA技术检测到的另外5例患者包括1例EGFR L858R突变,2例EGFR L747_P753 del-insS突变,1例EGFR E746_S752del-insV突变和1例EGFR E746_A750 del-insIP突变。这表明与标准的组织检测方法相比,PE cfDNA的突变检测能力有所提高。AlphaLiquid 100 panel检出了36例(92.3%)有所有致癌突变的患者,包括EGFR (Cobas)检测中的非热点突变。与传统的细胞块检测相比,额外的11例患者包括3例非热点EGFR突变、3例KRAS突变、2例Met-14跳跃、1例NRAS突变、1例BRAF突变和1例ERBB2扩增(表2;图1)。此外,即使使用非常低的cfDNA输入,也实现了高检出率(图2)。与其他基于组织的NGS研究相似,对PE cfDNA的分析揭示了主要驱动突变和各种共变异(图3)。
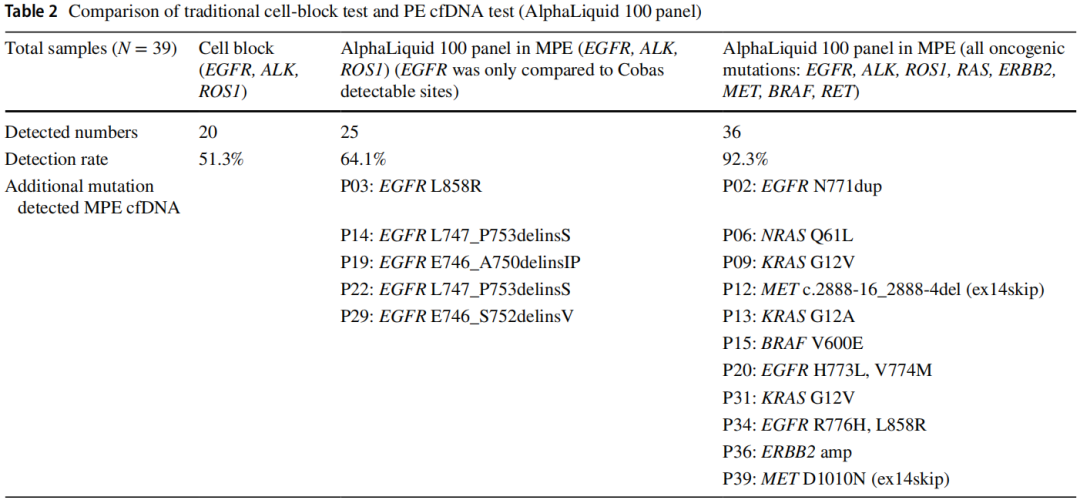
表2
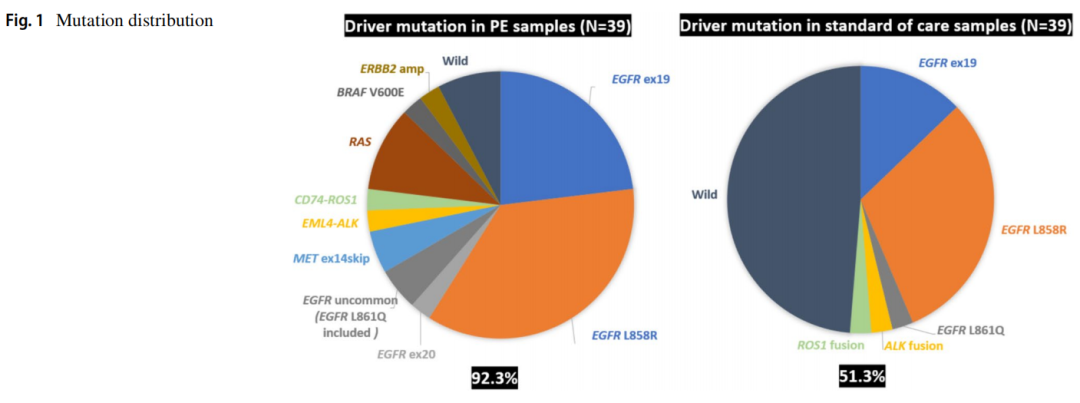
图1
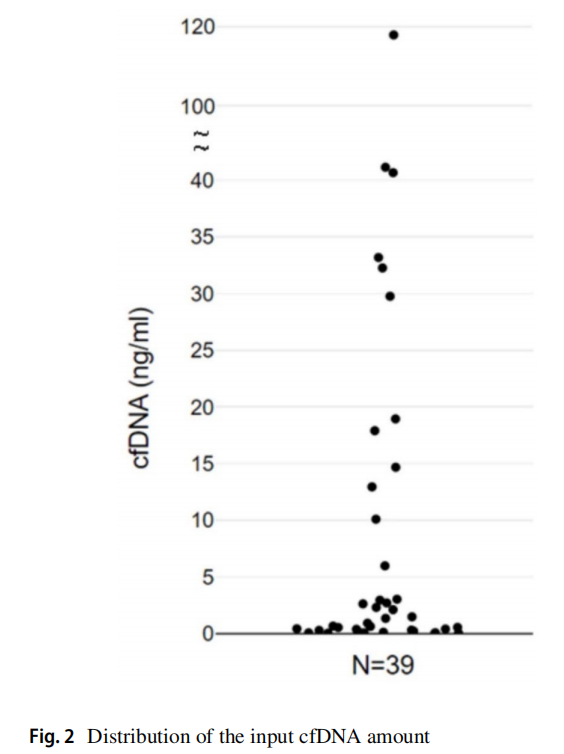
图2
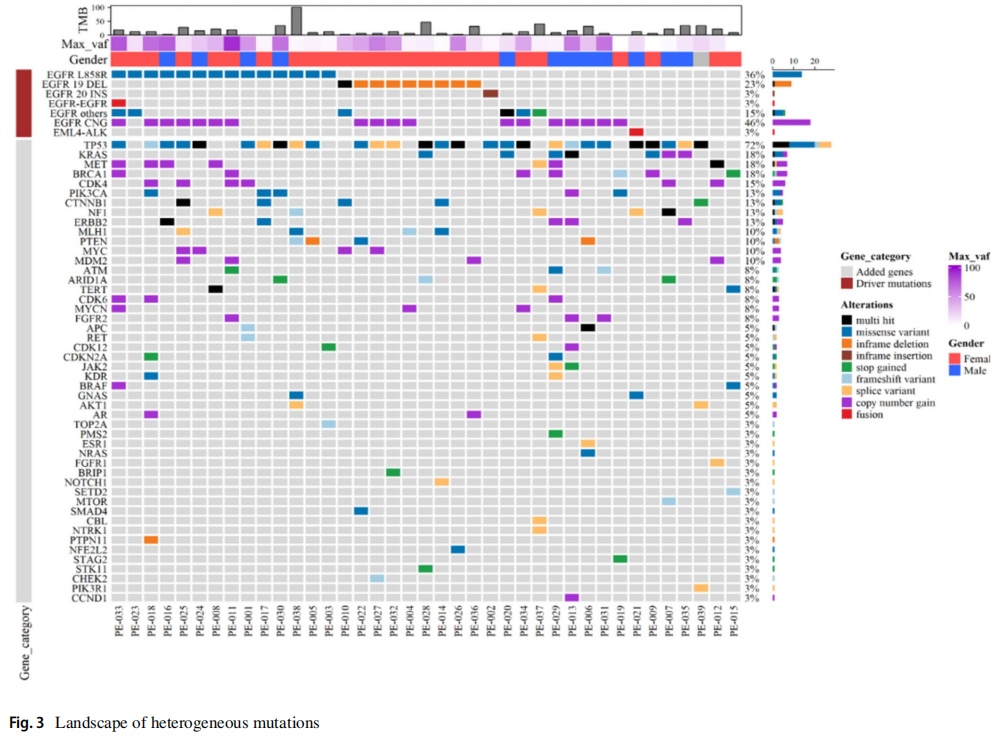
图3
研究者同时分析了EGFR突变患者接受EGFR-TKI治疗后3个月的疗效。在细胞块和cfDNA检测均为EGFR阳性的18例患者中,17例(94.4%)在接受EGFR-TKI治疗后3个月显示部分肿瘤缓解。相比之下,在细胞块EGFR检测为阴性但cfDNA检测为阳性的8例患者中,所有患者(100%)在接受EGFR-TKI治疗后3个月时均显示出部分肿瘤缓解(表3)。
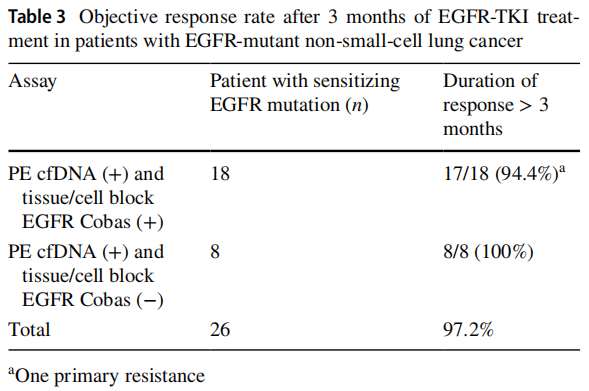
表3
讨 论
据研究者所知,这是第一项从PE提取的cfDNA中评估致癌突变的诊断潜力的研究。研究者将这些结果与来自台湾各中心的临床标本进行了比较。在肺腺癌患者的胸腔积液中,识别可作为治疗靶点的基因突变的主要方法是使用从沉淀中分离出的恶性细胞进行PCR或NGS。在本研究中,如果组织样本不是通过PE获得的,39例患者中只有18例(46.2%)成功进行了组织活检,而21例(53.8%)无法进行组织活检。这一发现强调了PE在样本采集中的重要作用。
之前的研究利用PE的细胞沉淀物或上清液检测EGFR突变,采用多种方法,包括Sanger测序、扩增阻滞突变系统(ARMS)PCR、突变特异性PCR、数字PCR和NGS。在接受相应组织活检的患者中,cfDNA在上清液、沉淀物和血浆中的突变检测灵敏度分别为93%、90%和63%。cfDNA在上清液中的浓度高于沉淀液或血浆中的浓度,并且与其他样本相比,cfDNA显示出更独特的突变谱。这表明,与沉淀或血浆样本相比,从上清液中提取的cfDNA具有更高的灵敏度和突变谱多样性。在最近一项纳入有MPE且肺腺癌细胞学结果阳性患者的研究中,胸膜细胞学在约71.4%的病例中发现了可作为靶点的突变。在另一项研究中,胸腔积液细胞学检测肺腺癌患者恶性肿瘤的诊断准确性为80.2%。在本研究中,对PE沉积物的标准细胞块进行EGFR(Cobas)、ALK(IHC)和ROS1(IHC)检测,可在约51.3%的病例中检出突变,而使用AlphaLiquid 100 panel进行的PE cfDNA分析可在64.1%的病例中检出突变。在台湾全民健康保险的覆盖范围内,如果仅纳入常规检查,可能会错过许多可从靶向药物治疗中获益的患者。在另外5例患者中使用cfDNA技术检测到了EGFR突变热点区域(L858R、L747_P753 del-insS、E746_S752del-insV和EGFR E746_A750 del-insIP)。也就是说,PE-cfDNA NGS法比沉淀物细胞块Cobas EGFR突变检测法检出更多的致癌突变。使用PE cfDNA鉴定出的致癌突变的总发生率为92.3%。因此,与细胞块Cobas试验相比,cfDNA技术在检测胸腔积液突变方面具有更大的临床效用。
其他患者包括有非热点EGFR突变、KRAS、Met-14跳跃、NRAS、BRAF突变和ERBB2扩增的患者。使用cfDNA可识别罕见突变,从而实现更有效的靶向治疗。本研究提示,分析从PE提取的cfDNA可以提供关于个体癌症的有价值的基因组见解,补充和丰富从组织活检获得的数据。
既往研究报道5 mL胸腔积液即可确诊恶性。在本研究中,82.1%的患者有小于10%肿瘤含量的PE;然而,所有病例均成功进行了cfDNA突变分析。本研究中的大多数患者有低肿瘤负荷的PE;然而,cfDNA分析仍然是可行的。
先前的研究表明MPE适用于细胞块中EGFR和ALK突变的检测。为了验证本研究数据的准确性,研究者在检测结果呈阳性、靶向药物治疗3个月后的患者中观察到肿瘤缩小。在本研究中,59%的患者携带EGFR L858R或外显子19缺失突变,所有患者均接受了第二代或第三代EGFR抑制剂治疗。值得注意的是,96.2%的EGFR阳性患者的缓解持续时间超过3个月,只有1例患者出现原发性耐药。这些结果表明,尽管存在基因突变异质性,但MPE上清液在检测基因变异方面与沉淀样本同样有效。有研究表明,TP53和CTNNB1突变或EGFR、MET、MYC和MDM2扩增可能与较短的EGFR-TKI反应持续时间和较差的临床预后相关。本队列需要进一步分析与一线EGFR-TKI治疗持续时间相关的这些危险因素。
细胞学检测仍是诊断PE的金标准。然而,在细胞学结果为阴性的积液患者中建立MPE诊断可能具有挑战性。由于肿瘤细胞数量少,细胞学阴性的PE标本通常被认为不适合EGFR检测。先前的研究表明,在非恶性细胞的cfDNA样本中不能检测到EGFR突变。然而,本研究发现,尽管多达82.1%的患者的细胞学细胞块中肿瘤细胞少于10%,但通过PE cfDNA鉴定出的致癌突变的总体检出率达到了92.3%的高检出率。
本研究有一些需要解决的局限性。本研究承认样本量小(39名受试者)是一个局限性,这可能影响研究结果的普遍适用性。未来需要更大的队列研究来验证和确认这些结果。由于研究资源有限,未同时进行PE上清液和PE沉淀块的NGS检测。研究者无法研究组织DNA、血浆cfDNA、PE上清液和沉淀物之间的一致性。在EGFR-TKI治疗3个月后,EGFR阳性患者的肿瘤缩小和客观治疗反应率为97.2%,验证了本研究结果的准确性。然而,除EGFR突变患者外,并非所有有基因变异的患者都接受了靶向治疗。需要开展更多研究来验证这些发现。此外,研究者无法全面比较每种样本类型的能力。液体cfDNA的性质可能限制了罕见融合事件的检出。然而,PE的扩增阈值需要进一步验证。
这项在台湾进行的开创性真实世界研究证实,从晚期NSCLC患者收集的PE上清液在检测突变方面是高度可靠和有效的。除了血浆和肿瘤检测之外,PE上清cfDNA的基因分型在临床实践中也是可行的,可提高诊断率,并扩大患者从靶向治疗中获益的潜力。
因此,我司统计了近期连续使用胸腹水上清检测肺癌NGS项目的基因突变阳性率(有重要/潜在临床意义的基因位点),受限于临床信息,下列数据未区分病理类型、临床分期、治疗史等因素:肺癌靶向11基因89.95%(179/199),肺癌靶向18基因92.21%(142/154),肺癌76基因96.26%(206/214)。这些数据表明,我司基于胸腹水上清cfDNA进行NGS检测的阳性率也很高,与本研究中报道的一致。因此,胸腹水上清是一种可行的检测样本。
参考文献:
Chang SC, Wei YF, Chen CY, et al. Profiling Cell-Free DNA from Malignant Pleural Effusion for Oncogenic Driver Mutations in Patients with Treatment-Naive Stage IV Adenocarcinoma: A Multicenter Prospective Study. Mol Diagn Ther. Published online August 15, 2024. doi:10.1007/s40291-024-00736-8



