【论著】基于卷积神经网络的颅内囊状动脉瘤半自动分割模型的构建与验证研究
时间:2024-10-20 15:01:39 热度:37.1℃ 作者:网络
摘要:目的基于卷积神经网络创建一种半自动的颅内囊状动脉瘤分割技术。方法回顾性连续纳入2017年7月至2020年7月“中国颅内动脉瘤计划”数据库中首都医科大学宣武医院的单中心数据,所有数据在分析前均进行了匿名处理。收集所有患者的基线资料,包括性别、年龄(≥60岁和<60岁)和DSA机型、DSA序列数及动脉瘤信息,包括动脉瘤个数、直径(≥5mm和<5mm)、颈宽(宽颈、窄颈)及位置(分叉部、侧壁)。根据8∶1∶1的比例将数据通过随机数字表法随机分为训练集、测试集和验证集。3个数据集患者的DSA三维断层数据均采用三维旋转DSA模式在造影机完成,并由3位有经验的神经外科医师对DSA三维断层数据显示的动脉瘤进行标注,并最终生成动脉瘤的标准标签。动脉瘤分割模型包括训练阶段和分割阶段。训练阶段,使用训练集的DSA三维断层图像数据与动脉瘤的分割标签以及通过Marching Cubes算法提取的血管边缘信息,对模型进行端到端的训练,在测试集上监控模型的分割指标,保留分割指标最高的模型。分割阶段,医师在验证集的动脉瘤DSA三维断层图像上选择一个动脉瘤内部的点,截取感兴趣体积(VOI),输入训练好的血管与动脉瘤分割最优模型,得到动脉瘤的分割结果,将分割的VOI定位回原始DSA三维断层图像以获得最终的动脉瘤轮廓。将分割网络模型的分割结果与人工获取的标准标签进行比较,以计算Dice相似系数(DSC)。对验证集数据按照动脉瘤直径、颈宽、位置进行分层,以比较不同亚组间的DSC。计算动脉瘤分割掩膜的长、宽和高的边界框,将其中的最大值作为动脉瘤的最大直径,与标准标签中的最大直径进行对比。在验证集中统计并比较颅内动脉瘤标准标签人工获取时间与分割网络模型获取时间(从定位动脉瘤到获取满意的动脉瘤颈分割时间)。结果最终纳入了756例患者的969个DSA序列显示的1094个动脉瘤的三维断层数据。其中,训练集纳入604例患者共783个DSA序列的877个动脉瘤,测试集纳入77例患者共100个DSA序列的117个动脉瘤,验证集纳入75例患者共86个DSA序列的100个动脉瘤。(1)各数据集基线比较结果显示,动脉瘤直径(P=0.003)、动脉瘤位置(P=0.003)的各数据集间的差异有统计学意义。余基线资料各数据集间差异无统计学意义(均P>0.05)。(2)验证集中动脉瘤分割的平均DSC为0.868±0.078。直径≥5 mm的动脉瘤分割的平均DSC高于直径<5mm的动脉瘤(0.891 ± 0.041比0.855 ± 0.088, P=0.038)。窄颈、宽颈、分叉、侧壁动脉瘤分割的DSC值分别为0.882 ± 0.065、0.859 ± 0.085、0.876 ± 0.072及0.863 ± 0.080,组间差异均无统计学意义(均P>0.05)。(3)动脉瘤分割模型在验证集所得到的掩膜最大直径与人工分割获得的标准标签的最大直径有较好的一致性[(5.78 ± 3.18)mm比(5.37 ± 2.92)mm,r=0.97]。在验证集中,人工分割与应用神经网络分割动脉瘤的平均时长分别为2.5min、34s。结论本研究基于卷积神经网络创建半自动的颅内囊状动脉瘤分割技术可较为准确分割动脉瘤,该模型有助于动脉瘤形态学分析。
颅内囊状动脉瘤(如下文本中无特别说明,统称为“动脉瘤”)是指由于受长期不稳定血流的冲击,颅内血管壁薄弱区域发生的病理性膨胀,成年人平均患病率约为3.2%。动脉瘤破裂可能是致命的,35%的患者可发生蛛网膜下腔出血。因此,动脉瘤的检出、诊断、治疗策略和预后预测是神经外科及神经介入科医师的主要关注点。近年来,人工智能技术在动脉瘤检出、破裂风险评估和治疗预后预测方面取得了突破性进展,已成为动脉瘤诊断和治疗的重要辅助手段。
动脉瘤的形态学分析是动脉瘤治疗决策的重要部分,与动脉瘤破裂风险评估和介入手术器材选择密切相关。识别和准确分割动脉瘤颈部是动脉瘤形态参数是否能被准确测量的关键因素。多项辅助计算机技术已用于辅助动脉瘤颈部分割,但其在临床实践中的应用尚不广泛,可能是由于其在分割分叉部动脉瘤或含分支血管的动脉瘤时效果仍不佳。本研究拟通过学习有经验医师的动脉瘤分割方法,创建一种基于卷积神经网络的半自动动脉瘤分割技术,为动脉瘤形态学参数的准确测量提供帮助,并进一步有助于破裂风险预测或栓塞装置选择。
1 对象与方法
1.1 对象
回顾性连续纳入2017年7月至2020年7月“中国颅内动脉瘤计划”数据库中首都医科大学宣武医院的单中心数据,所有数据在分析前进行了匿名处理。本研究方案经首都医科大学宣武医院伦理委员会审核批准(临研审[2017]082号),所有参与者均签署数据使用的书面知情同意书。
纳入标准:(1)至少有1个影像学确诊的颅内未治疗动脉瘤患者;(2)患者至少进行过1次DSA影像学检查,动脉瘤DSA断层数据可从影像工作站获取;(3)患者签署了数据使用的书面知情同意书。排除标准:(1)非囊性动脉瘤、外伤性动脉瘤或细菌性动脉瘤;(2)患者参加或正在参加其他临床试验;(3)患者数据不完整;(4)图像质量不佳。
1.2 基线资料
收集所有患者的基线资料,包括性别、年龄(≥60岁和<60岁)和DSA机型、DSA序列数及动脉瘤信息,包括动脉瘤个数、直径,颈宽及位置。基于既往文献动脉瘤大小分组标准,动脉瘤直径被分为≥5 mm和<5 mm。颈宽是指颈平面的最大直径,将所有动脉瘤分为宽颈和窄颈动脉瘤,宽颈动脉瘤定义为动脉瘤直径与颈宽的比值<2或颈宽>4mm,均不满足者则为窄颈动脉瘤。动脉瘤位置分为分叉部和侧壁动脉瘤,其中侧壁动脉瘤定义为由一个载瘤动脉供血,任何小分支的直径小于载瘤动脉的五分之一;分叉动脉瘤定义为位于脑血管的分叉处,任何分支动脉的直径不小于动脉瘤载瘤动脉的五分之一。根据8∶1∶1的比例将数据按照随机数字表法随机分为训练集、测试集和验证集,尾号数字为0的患者划分到验证集,尾号数字为1的患者划分到测试集,其余为训练集患者。
1.3 DSA三维扫描
所有患者的DSA三维断层数据采用三维旋转DSA模式在造影机完成,选择200°的旋转角度,以捕捉完整的载瘤动脉解剖结构。扫描的帧率设定为每秒15帧,使用碘基对比剂,流速设定为3 ml/s,注射总剂量为18 ml,以确保动脉的对比剂充盈度。注射压力设定为200 PSI。扫描范围以动脉瘤位于视野中央,基本包全载瘤动脉及其远端血管。
1.4 颅内动脉瘤手工标注
对DSA三维断层数据显示的动脉瘤进行标注,每个像素被分类为非血管区域、血管区域、动脉瘤区域。生成标签分为3个步骤。(1)使用分割与配准工具包(Insight Segmentation and Registration Toolkit 4.9.0, ITK 4.9.0)获取血管的大致范围,并生成血管种子点,通过区域生长算法将血管区域与非血管区域分离,非血管区域标签值设为0;(2)基于可视化工具包(Visualization Toolkit 7.0.0, VTK 7.0.0),使用Marching Cubes算法生成血管表面;(3)通过医学图像交互工具包(Medical Imaging Interaction Toolkit 201611,MITK 201611;德国癌症研究中心,德国)开发交互工具,采用手工分割的方式从血管表面分割动脉瘤囊。血管区域的标签值设为1,动脉瘤囊内的标签值设为2。颅内动脉瘤手工标注流程图见图1。
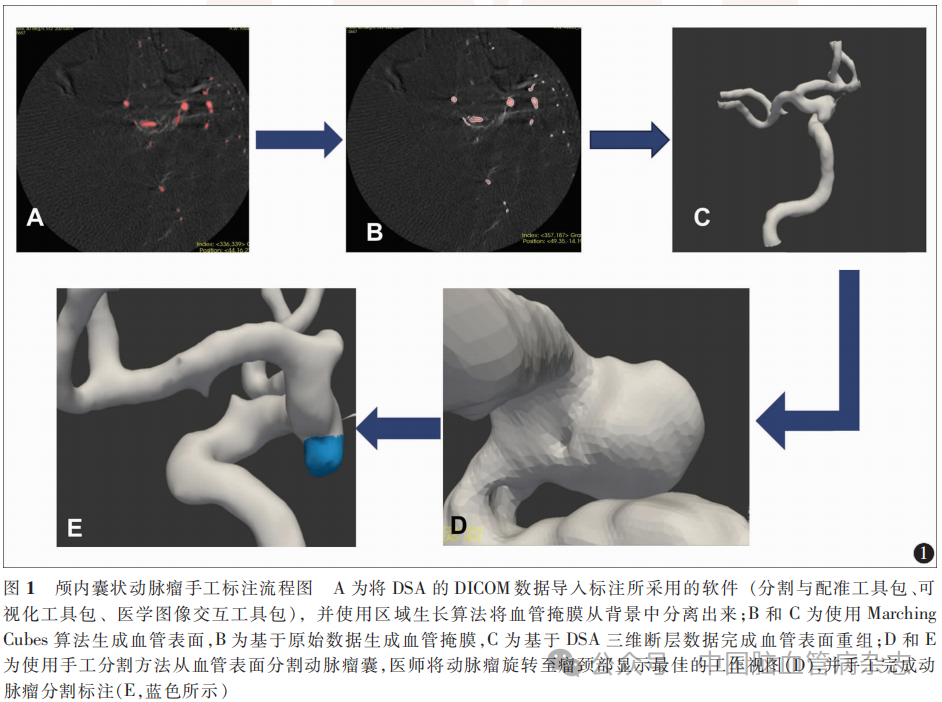
训练集和测试集颅内动脉瘤由1名具有颅内动脉瘤诊疗经验超过5年的医师标注,另有1名具有超过15年动脉瘤诊疗经验的高级医师对动脉瘤标注过程进行检查。验证集颅内动脉瘤由3名超过5年动脉瘤诊疗经验的医师分别标注,由上述具有超过15年动脉瘤诊疗经验的医师从中判定最接近实际动脉瘤的标注结果作为动脉瘤的标准标签。
1.5 机器学习
1.5.1数据集和数据增强:在动脉瘤标注过程后,我们得到了每个动脉瘤的DSA三维断层数据及其每个像素点的标签,作为开发及评估动脉瘤分割精度的数据集。本研究提出的动脉瘤分割方法包括训练阶段和分割阶段。
将训练集动脉瘤的DSA三维断层数据及其每个像素点的标签数据以动脉瘤的中心为中心进行局部分割,裁剪为包含动脉瘤区域的96×96×96个体素的感兴趣体积(volume of interest, VOI),像素间距设定为0.227mm,以减少计算成本。将采用Python创建的数据增强方案应用于训练集动脉瘤,以提高动脉瘤分割模型的泛化能力。数据增强方法包括:在3个轴上随机旋转45°、缩放范围为70%~150%、3个轴上的50%随机翻转及其他基于灰度的数据增强,该数据增强方法使用了与nnU-Net相同的数据增强方式,即高斯模糊、亮度、对比度调整和伽马增强。
1.5.2血管与动脉瘤的网络结构分割:采用U形网络结构(编码器与解码器网络架构)对训练集动脉瘤进行分割,如图2所示。编码器与解码器网络架构使用TensorFlow 2.4.0创建。网络按照原始U-Net结构构建,编码器和解码器的每一层由1个采用3×3×3卷积核的卷积层、1个组归一化层和线性激活层组成。输入的96×96×96×1灰度图像(96指VOI的边长为96个体素,1为通道数),通过8个卷积块和4个最大池化层编码成大小为6×6×6个体素,通道数为512的特征图,不同的通道可编码不同的特征,这些特征由反向传播,直接从数据中学习获得。通过4个上采样块,将编码的特征解码为96×96×96×3的掩膜,3个通道分别为非血管区域、动脉瘤囊以外的血管区域和动脉瘤囊的分割结果。上采样采用步幅为2的反卷积块来实现。所有卷积层后面均衔接挤压和激发层(squeeze and excitation layers,SE)以进一步提升模型分割性能。将通过Marching Cubes算法(scikit-image 0.18.3)提取的边缘信息应用于动脉瘤和血管表面以辅助模型收敛。
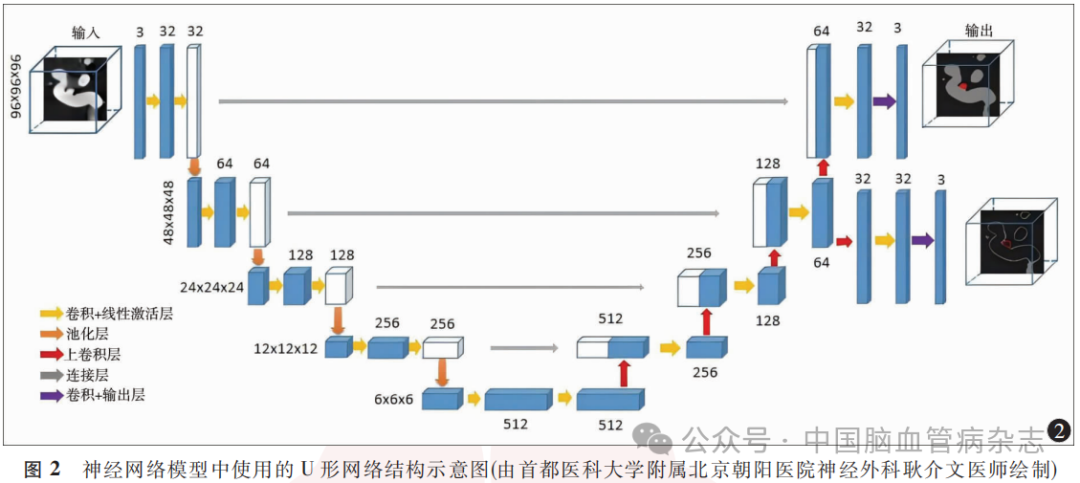
1.5.3血管与动脉瘤分割网络优化:为了获得更准确的分割结果并支持后续的形态学分析,本研究使用了3个方向上像素间距为0.227mm的高分辨率图像。训练阶段,在动脉瘤上任意选择一个点作为中心点,并截取目标VOI(96×96×96个体素)。在应用阶段,由神经外科医师选择动脉瘤内部靠近中心位置的VOI的中心点。
血管与动脉瘤分割网络在NVIDIA Titan V GPU服务器上运行,训练集共有877个动脉瘤VOI,每次取2个动脉瘤VOI进行训练,439次能对数据集进行一次完整的学习循环,总计重复1000个循环。采用Adam优化器对分割网络进行训练,初始学习率设置为0.001。在整个训练过程中将学习率根据nnU-Net中使用的多项式学习率策略递减。在训练集动脉瘤的训练阶段,监控测试集血管与动脉瘤分割模型在血管及动脉瘤分割的损失值,并保留损失值最低的血管与动脉瘤分割模型。测试集的预处理仅包括VOI内的归一化。将在测试集中表现最好的血管与动脉瘤分割网络作为在验证集上评估血管与动脉瘤分割模型的最终指标。
通过动脉瘤及血管分割的Dice相似系数(dice similarity coefficient, DSC)损失值对血管与动脉瘤分割网络进行优化,DSC损失值=1-DSC,权重为10∶1。DSC计算公式如下:
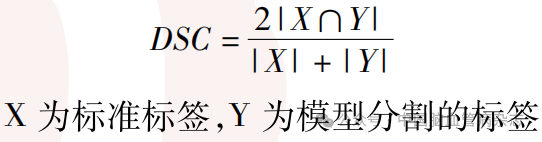
在验证阶段,医师在验证集的动脉瘤DSA三维断层图像上选择一个动脉瘤内部的点,该点应尽量靠近动脉瘤的中心,作为VOI中心,裁剪96×96×96个体素大小的VOI,输入训练好的血管与动脉瘤分割网络,进行端到端的血管和动脉瘤分割,然后将分割的VOI定位回原始DSA三维断层图像以获得最终的动脉瘤轮廓。
1.6 血管与动脉瘤分割模型效能分析
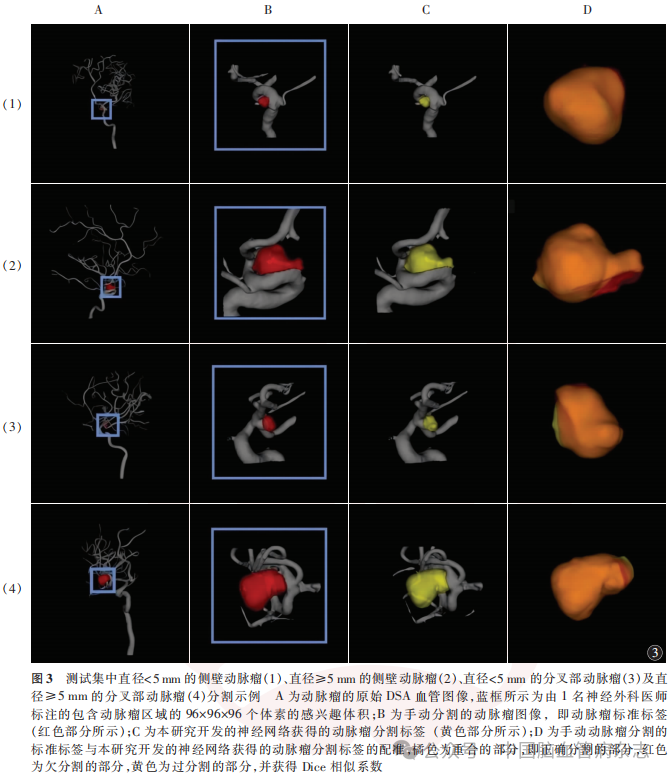
使用训练的血管与动脉瘤分割网络模型对验证集中动脉瘤图像进行分割。将分割网络模型的分割结果与标准标签进行比较,以计算DSC。测试集中直径<5mm的侧壁、分叉部动脉瘤及直径≥5mm的侧壁、分叉部动脉瘤的分割示例见图3。对验证集数据按照动脉瘤直径、颈宽、位置进行分层,以比较验证集不同亚组间的DSC。计算动脉瘤分割掩膜的长、宽和高的边界框,将其中的最大值作为动脉瘤的最大直径,与标准标签中的最大直径进行对比。在验证集中统计并比较标准标签人工获取时间与分割网络模型获取时间(从定位动脉瘤到获取满意的动脉瘤颈分割时间)。
1.7 统计学分析
使用SPSS22.0版本(IBM,Armonk,美国)对所有数据进行统计。采用PP图方法对所有获得的DSC数据进行正态性检验,符合正态分布的计量资料用x-±s表示,组间比较用两独立样本t检验。基线计数资料用例(%)或个(%)表示,组间比较采用列卡方检验。使用Pearson相关系数评估动脉瘤分割掩膜的最大直径与标准标签中的最大直径之间的相关性。所有P值均基于双尾统计学检验,以P<0.05为差异有统计学意义。
2 结果
本研究使用的DSA机型包括GE (GE Healthcare,美国),Philips (Philips Healthcare, 荷兰)以及Siemens (Siemens Healthineers,德国)。最终根据纳入和排除标准纳入了756例患者的969个DSA序列显示的1094个动脉瘤的三维断层数据。训练集共604例患者783个DSA序列877个动脉瘤。测试集共77例患者100个DSA序列117个动脉瘤。验证集共75例患者86个DSA序列100个动脉瘤。
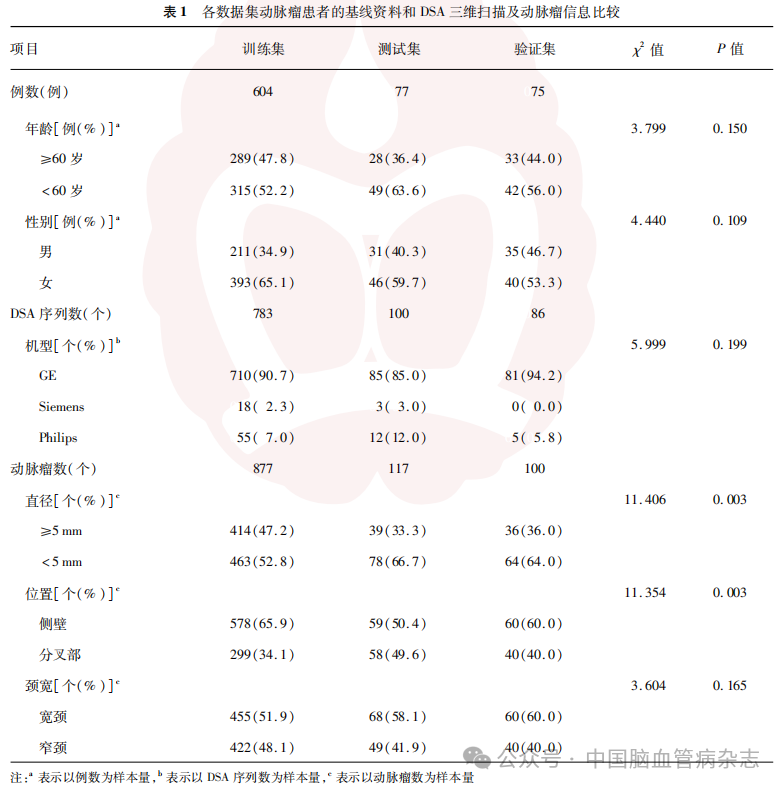
2.1 患者基线资料和DSA三维扫描及动脉瘤信息比较
比较结果显示,动脉瘤直径(P=0.003)、动脉瘤位置(P=0.003)的组间差异均有统计学意义。余基线资料各数据集间差异均无统计学意义(均P>0.05)。见表1。
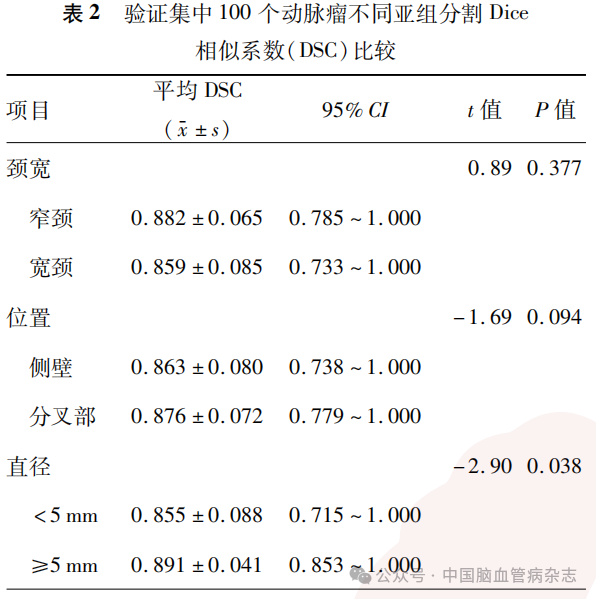
2.2 验证集中不同亚组动脉瘤分割的DSC
验证集中100个动脉瘤分割的平均DSC为0.868±0.078。直径≥5mm的动脉瘤分割的平均DSC高于直径<5mm的动脉瘤(0.891±0.041比0.855±0.088),差异有统计学意义(P=0.038)。窄颈、宽颈、分叉、侧壁动脉瘤分割的DSC值分别为0.882±0.065、0.859±0.085、0.876 ± 0.072及0.863±0.080,组间差异均无统计学意义(均P>0.05)。见表2。
2.3 人工分割与网络分割动脉瘤的最大直径与分割时长比较
动脉瘤分割模型在验证集所得到的掩膜最大直径测量值与人工分割获得的标准标签有很好的一致性[(5.78 ± 3.18)mm比(5.37 ± 2.92)mm,r=0.97]在验证集中,人工分割与应用网络分割动脉瘤的平均时长分别为2.5min、34s。
3 讨论
与CT血管成像(CTA)和MR血管成像(MRA)相比,DSA对动脉瘤及其周围小血管的发育情况的检测具有更高的敏感性。因此,DSA仍然是动脉瘤诊断和治疗前评估的主要方法。本研究重点为基于DSA的动脉瘤分割。二维动脉瘤测量在临床工作中忽略了工作角度的问题,越来越多的研究使用三维重组来测量动脉瘤,然后选择工作角度(医师将动脉瘤旋转到一个角度,以完全暴露动脉瘤的颈部和体部,以便于测量动脉瘤或行血管内治疗)。然而,由于不同医师选择的测量视角不同,这种测量方法很可能在不同医师中形成测量差异,因此准确性不足。基于动脉瘤的三维形态学参数的测量有助于解决上述问题。目前多项基于计算机算法的半自动动脉瘤分割方法已经发布。但是,既往基于动脉瘤载瘤动脉中心线重组的分割方法在实际应用于分叉动脉瘤时可能因为中心线计算不准确需要进行多次调整,从而增加了动脉瘤分割时间。有研究基于神经网络开发了颅内动脉瘤的分割模型,但多为基于二维DSA进行分割,在临床应用中仍忽略了最优的工作角度选择。
与既往的动脉瘤检测算法(同为从医师的动脉瘤分割标签中学习)不同,本研究采用的算法侧重于动脉瘤颈部分割。目前的算法从有经验的神经外科医师的动脉瘤分割标签中学习,可能能够为当前的自动分割遇到的上述问题提供有效的解决方案。在我们既往的研究中,已经开发了动脉瘤自动测量和基于DSA的动脉瘤自动检测算法,本研究开发的半自动分割方法可与上述两种算法结合,以实现颅内动脉瘤的全自动分割和三维形态分析。三维形态分析目前已成为动脉瘤风险评估及手术决策重要的依据,本研究中所采用的动脉瘤分割模型能够将动脉瘤准确且高效地分割出来,从而有利于进一步的自动化动脉瘤三维分析。
本研究中所采用的动脉瘤分割方法不是完全自动化的方法。完全自动分割算法的输入是完整的医学图像。无论是直接对整个图像进行分割,还是首先做检测步骤,然后在检测到的动脉瘤上进行分割,中央处理器和图形处理器的资源占用都相对较大,对部署服务器的要求也相对较高,特别是对于超高分辨率图像。本研究中所采用的半自动分割算法更适合轻量级的计算机内存部署,动脉瘤的分割在医师指定的固定大小的ROI内进行,资源占用可控且高效。消除了来自非动脉瘤周围区域的干扰,可以实现更高的分割精度。
我们采用了与nnU-Net相同的图像灰度值增强策略,该策略在大量数据集上得到了验证。与nnU-Net不同,本研究的模型未采用多层深度监督结构,我们希望本研究开发的分割网络更关注最终的高分辨率输出,从而对动脉瘤颈部进行更细致的分割。此外,本研究为网络设计了一个辅助任务,即识别动脉瘤和血管表面周围的像素,有助于改进动脉瘤颈分割精度。
虽然在训练集、测试集中的动脉瘤与验证集中的动脉瘤特点(直径、位置)在基线对比中存在差异,但该差异为随机入组不同组集时产生,训练集有足量数据,使不同亚组动脉瘤在分割网络模型中得到了足量的学习,因此该差异不影响最终验证集结果。本研究结果表明,与神经网络应用于动脉瘤检出类似,直径≥5mm的动脉瘤分割比直径<5mm的动脉瘤DSC更高(DSC:0.891 ± 0.041比0.855 ± 0.088, P=0.038),这与预期结果一致。以往研究证明,直径≥5mm的动脉瘤比<5mm动脉瘤破裂或生长风险增加(HR=2.56,95%CI:1.93~3.39),并建议进行手术或介入治疗。因此,高精度的动脉瘤分割非常重要,本研究开发的神经网络分割模型具有较高的分割准确性,DSC为0.891。此外,本研究开发的神经网络分割模型在直径<5mm的动脉瘤中的分割仍然实现了0.855的DSC。近期有研究基于FSTIF-UNet的分割模型实现了DSC为0.8486~0.8794的分割准确度;基于深度学习的DSA动脉瘤分割模型则实现了DSC为0.87的分割准确度。本研究中使用的算法获得的DSC与上述研究结果相近。
本研究存在一定的局限性,我们所采用的动脉瘤分割方法不是从数据输入到动脉瘤分割的完全自动化方法,动脉瘤的检测仍然需由经验丰富的医师处理。因此,该算法不具备区分动脉瘤与血管回路和血管漏斗的能力,这可能为其在临床中的应用带来限制。进一步的研究应集中在自动动脉瘤检测和动脉瘤瘤颈分割相结合方面,以建立全自动的动脉瘤分割及形态学分析算法。
综上所述,本研究开发了一种能够基于DSA半自动准确分割三维动脉瘤的神经网络模型,该模型有望准确分割动脉瘤,为进一步进行动脉瘤形态学分析和栓塞装置选择奠定良好基础。未来的研究应致力于进一步优化该模型,并将其应用于更多临床数据以验证其泛化能力。


