BRAF突变局晚/晚期NSCLC免疫治疗有希望!新辅助免疫联合化疗pCR率高达100%
时间:2024-10-20 06:00:57 热度:37.1℃ 作者:网络
基于免疫疗法的治疗已在晚期和局部晚期非小细胞肺癌(NSCLC)患者中显示出较高的疗效。BRAF 突变影响一小部分但重要的 NSCLC。这些疗法对这组患者的疗效尚不清楚。来自 NADIM 和 NADIM II 临床试验(NADIM 队列)中 116 例可切除 IIIA/B 期 NSCLC 患者,以及前瞻性学术队列(BLI-O 队列)中 84 例 IV 期 NSCLC 患者的血浆和组织样本,进行了NGS检测。p.G464E、p.G466R、p.G466V、p.G469V、p.G597Q、p.T599I、p.V600E(n = 2)BRAF 突变见于 NADIM 队列中 4 例接受新辅助化疗+免疫治疗(CH-IO)的患者样本,以及 BLI-O 队列中 4 例(4.76%)接受一线免疫治疗(n = 2)或 CH-IO(n = 2)的患者样本。所有这些患者在数据截止时均存活,且没有疾病迹象。相反,BLI-O 队列中 BRAF 野生型(wt)肿瘤患者的中位无进展生存期(PFS)为 5.49 个月,中位总生存期(OS)为 12.00 个月(P-LogRank = 0.013 和 0.046)。类似地,NADIM 队列中 BRAF-wt 肿瘤患者在 36 个月时的 PFS 和 OS 率分别为 60.5% 和 76.1%。BRAF 阳性肿瘤患者(n = 4)新辅助 CH-IO 后的病理完全缓解(pCR)率为 100%,而 BRAF-wt 人群的 pCR 率为 44.3%(RR:2.26;95 % CI:1.78-2.85;P < 0.001)。本研究表明,BRAF 突变可能是接受基于免疫疗法的治疗的晚期和局部晚期 NSCLC 患者的预后较好因素。
研究背景
基于免疫疗法的治疗已成为晚期和局部晚期非小细胞肺癌(NSCLC)患者的高疗效疗法。
在 NSCLC 中遇到的不同分子改变中,BRAF 突变发生在一小部分但重要的肿瘤亚群中。具体来说,BRAF 突变约占 NSCLC 病例的 1-5%。BRAF 编码一种参与丝裂原活化蛋白激酶(MAPK)信号通路的蛋白,调节细胞增殖和分化。这些通路失调是多种实体瘤的标志。大多数 BRAF 突变被归类为 I 类,发生在密码子 600 处,其中 BRAF p.V600E 是实体瘤中最常见的突变,是识别可能获益于 BRAF 抑制剂的患者的重要生物标志物。II 类突变,定义为非 V600 突变,以 RAS 非依赖性二聚体的形式激活 BRAF 信号传导,而 III 类突变具有低/不存在激酶活性,需要额外的上游信号传导。
BRAF 突变在其他癌症中得到了许多研究,但关于其对 NSCLC 治疗结局的影响,受到的关注有限,主要是由于 BRAF 阳性 NSCLC 患者较少。因此,有关免疫检查点抑制剂(ICI)在 BRAF 阳性 NSCLC 中的疗效的研究较少,并且对于基于免疫疗法的治疗vs靶向治疗作为治疗 I 类 BRAF 突变肿瘤的首选方法的适用性仍然存在疑问。以这种方式,法国的一项研究表明,在既往接受过治疗的 BRAF 突变 NSCLC 中,ORR(客观缓解率)为 24%,中位 PFS(无进展生存期)为 3.1 个月。
另一方面,ICI 是携带 BRAF V600 突变的黑色素瘤患者的有效治疗选择。最近的研究还表明,BRAF 阳性 NSCLC 对 ICI 可能敏感。一项回顾性研究分析了 3 个独立的具有癌基因变异的 NSCLC 患者队列(总 n = 4189),结果显示,在肿瘤携带 p.V600E BRAF 突变的患者中,ICI 带来 PFS 获益。
本研究旨在利用 NADIM 和 NADIM II 临床试验的数据,探索 BRAF 突变对接受新辅助化疗+免疫治疗(CH-IO)的局部晚期 NSCLC 患者的预后影响。此外,本研究将其范围扩大到包括接受一线免疫治疗或 CH-IO(BLI-O 队列)的 NSCLC 患者的学术队列。
研究结果
本研究使用了两个不同的患者队列,即 NADIM 队列和 BLI-O 队列。NADIM 队列包括 116 例可切除的 IIIA/B 期 NSCLC 患者,这些患者入组了 NADIM(NCT03081689;n = 46)和 NADIM II(NCT03838159;实验组,n = 46;对照组,n = 24)临床试验。NADIM 试验和 NADIM II 试验实验组患者接受新辅助纳武利尤单抗加铂类化疗,然后接受纳武利尤单抗辅助治疗。我们分析了 NADIM 队列中的 99 个基线血浆样本和 70 个福尔马林固定石蜡包埋(FFPE)治疗前活检样本。BLI-O 学术队列包括来自 IV 期 NSCLC 患者的 84 个血浆样本,这些患者是接受基于免疫疗法的治疗的候选者。对于 BLI-O 队列,排除了 EGFR 或 ALK 突变或重排检测呈阳性的肿瘤。在开始一线免疫治疗或 CH-IO 治疗之前收集样本。在 BLI-O 队列中,治疗选择由医生决定。
BRAF致癌突变
识别了 8 例肿瘤携带致癌 BRAF 突变的患者(表 1)。具体来说,其中4例样本(3.45%)在 NADIM 试验中检测呈阳性,所有这些患者都接受了新辅助 CH-IO(实验组)。类似地,BLI-O 队列中有 4 例样本检测呈阳性(4.76%)。其中,2 例为接受 CH-IO 的患者,其余 2 例为仅接受免疫治疗的患者。具体来说,我们发现了 7 种独特的突变,即 p.V600E(I 类突变)、p.G464E、p.G469V、p.L597Q、p.T599I(II 类突变)、p.G466R 和 p.G466V(III 类突变)。这些突变位于蛋白质的 P 环区域或激活环,调节蛋白质的激酶活性(图 1)。其中 7 个变异在液体活检样本中检出,突变丰度(MAF)范围为 0.11% 至 0.34%。此外,2 个 BRAF 突变在肿瘤活检样本中检出(表1)。
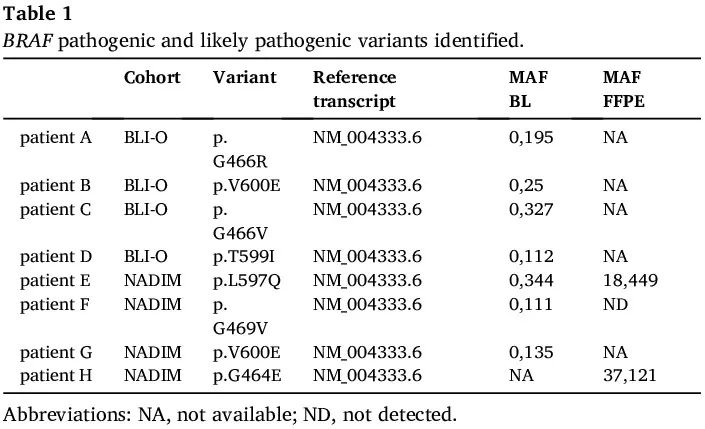
表1
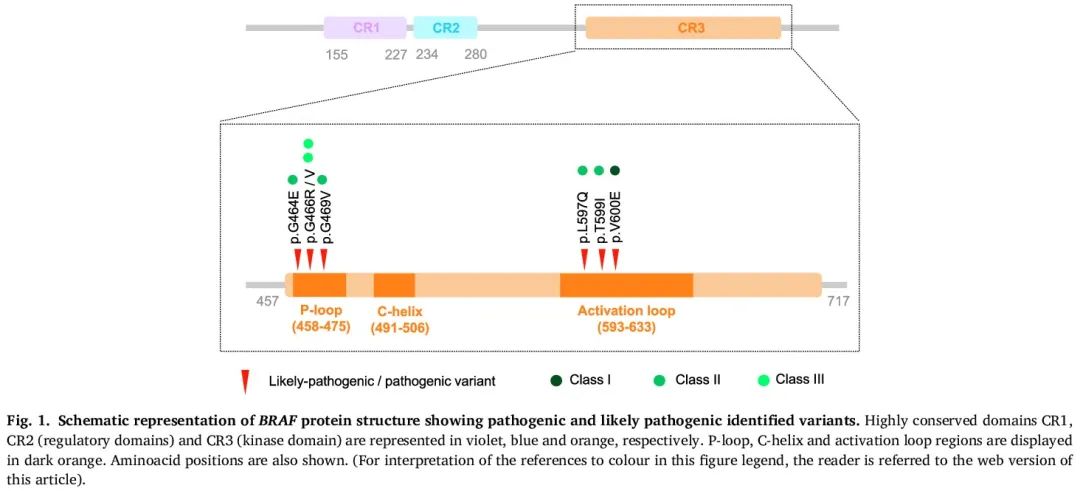
图1
为了验证 NSCLC 中致癌 BRAF 突变的发生率,我们在公开可用的数据集中评估了这些突变的存在。BRAF 突变的发生率在所有数据集中是一致的。在公共数据集中观察到的最常见的突变中,我们发现了 p.V600E、p.G466V,这些也在我们的队列中观察到。
此外,我们评估了 BRAF 阳性 NSCLC 中其他致病性和可能致病性突变的存在。除了 1 例肿瘤(患者 B,见表 1)外,其他所有肿瘤除了 BRAF 突变,还携带至少一个共突变。TP53 是最常见的共突变基因,5/8 例(62.5%)携带 TP53 突变,其次是 SMAD4 突变,发生率为 2/8(25.0%)。我们还发现了 KIT 或 MAP2K1 等基因变异。
NADIM 队列和 BLI-O 队列中 171 例病例有 PD-L1 数据(表 2)。未观察到 PD-L1 状态与 BRAF 突变显著相关,尽管2例携带 p.V600E 突变的病例 PD-L1 表达≥ 50%。
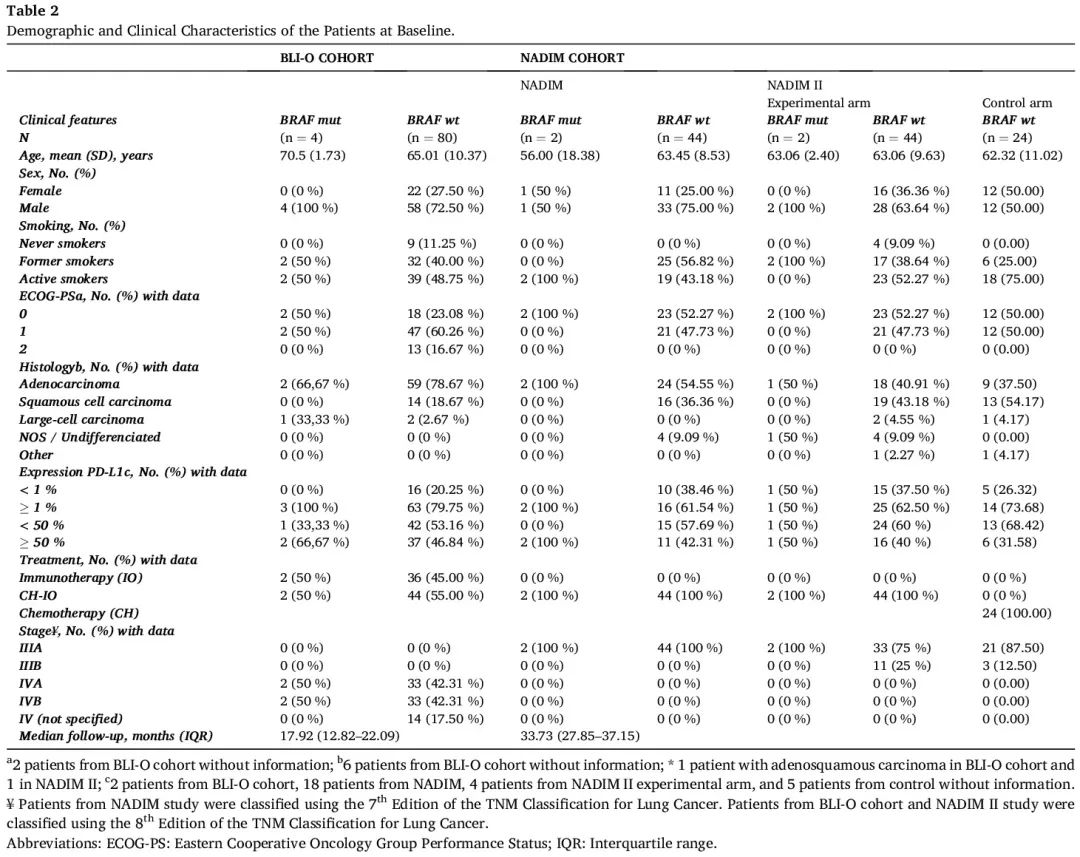
表2
NADIM 队列可进行 TMB 分析(n = 64)。BRAF-wt(n = 61)和 BRAF 阳性肿瘤(n = 3)之间没有显著差异,但2/3的 BRAF 阳性肿瘤(66.67%)TMB ≥20 个突变(mut)/Mb,而这一比例在 BRAF-wt 肿瘤中为 13.11%。
BRAF突变的预后价值
表 2 总结了研究中包括的患者的人口统计学和临床特征。根据我们的数据,BRAF 阳性肿瘤患者与 BRAF-wt 肿瘤患者具有相似的临床病理特征。分析的变量与 BRAF 突变状态之间没有显著相关性,包括性别、年龄、ECOG 、吸烟状况、组织学、分期、TMB 和 PD-L1 表达。
分析 NADIM 队列中 BRAF 突变的预后价值时,由于 NADIM II 试验的对照组患者(n = 24)没有 BRAF 突变且仅接受新辅助化疗,排除了这部分患者。
在接受新辅助 CH-IO 的患者亚群(n = 92)中,中位随访时间为 34.62 个月(四分位距:29.06 – 38.73 个月),12 个月时数据成熟度为 99.87%。在数据截止时,32 例患者(34.78 %)疾病进展,19 例(20.65 %)死亡。
在 NADIM 队列中,BRAF-wt 或 BRAF 阳性 NSCLC 患者的中位 PFS 和 OS 均未达到。然而,Kaplan Meier 曲线显示,肿瘤携带致癌 BRAF 突变的患者在数据截止时没有疾病迹象且存活(图 2 A、B),而 BRAF-wt 肿瘤患者在 36 个月时没有疾病迹象和存活的概率分别为 60.5% 和 76.1%。类似地,致癌 BRAF 突变与 CH-IO 新辅助治疗后的病理完全缓解(pCR)显著相关(p = 0.044)(图 3)。具体而言,对于 BRAF 阳性(n = 4)的患者,新辅助 CH-IO 后的 pCR 率为 100 %,而 BRAF-wt 人群的 pCR 率为 44.3 %(RR:2.26;95 %CI 1.78-2.85;P < 0.001)。
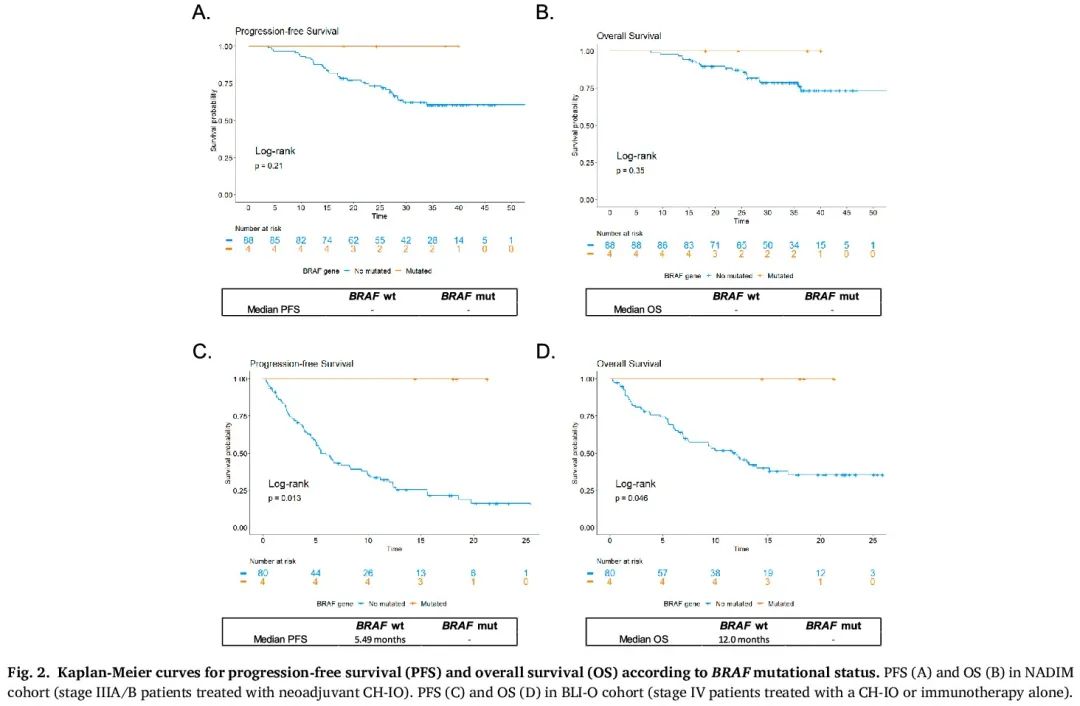
图2

图3
BLI-O 队列患者的中位随访时间为 17.92 个月(四分位距:12.82-22.09 个月),12 个月时的数据成熟度为 94.62 %。在研究期间,60 例患者(71.43%)疾病进展,46 例(54.76%)患者死亡。根据接受的治疗类型(仅免疫治疗或 CH-IO)分类,未观察到生存结局的显著差异。
肿瘤为 BRAF-wt 的 BLI-O 患者的中位 PFS 和中位 OS 分别为 5.49 个月和 12 个月,而 BRAF 突变肿瘤患者的中位 PFS 和 OS 未达到(PFS 的 LogRank p 值为 0.013,OS 为 0.046)(图 2 C、D)。值得注意的是,所有肿瘤携带致癌 BRAF 突变的患者在数据截止时均无疾病进展迹象且存活,而无致癌 BRAF 突变的患者 12 个月时无疾病进展的概率为 30.5%,12 个月时存活的概率为 48.7%。
讨 论
本研究分析了两个独立的 NSCLC 患者队列,以探索 BRAF 突变对基于免疫疗法的治疗的生存结局的影响。在 NADIM 队列中,所有 BRAF 阳性 NSCLC 患者在数据截止时均存活且没有疾病迹象,并且所有患者在 CH-IO 新辅助治疗后均达到 pCR。值得注意的是,证据表明,新辅助 CH-IO 后获得 pCR 与生存期延长高度相关。值得注意的是,这些结果是在较长随访期的情况下提供的,具有高度的数据成熟度。
我们认为这些信息具有重要意义,因为到目前为止,还没有文献支持在肿瘤 BRAF 阳性的 NSCLC 患者中使用新辅助 CH-IO。相反,目前倾向于探索新的辅助或新辅助靶向治疗,这一趋势可能是由于ADAURA试验中奥希替尼辅助治疗令人印象深刻的结局,以及将已知EGFR或ALK突变的患者排除在评估CH-IO联合治疗疗效的新辅助治疗试验之外。
在转移性环境中,BRAF pV600E突变NSCLC患者的一线治疗选择包括达拉非尼加曲美替尼作为标准治疗。其他针对 BRAF V600 突变 NSCLC 的靶向治疗方法也显示出有意义的临床益处。另一方面,免疫疗法对 BRAF 阳性 NSCLC 患者的潜在益处相对未得到充分探索。在 Dudnik E 等人的一项研究中,尽管发现 BRAF 阳性 NSCLC 与高水平的 PD-L1 表达之间存在显著关联,但 BRAF 突变状态与缓解率(ORR)或 PFS 无关。同样,Guisier F 等人未发现 BRAF 阳性 NSCLC 的 ICIs 疗效较高,尽管患者在 ICI 给药前接受过中位至少一线既往治疗。因此,总体而言,有关 BRAF 阳性 NSCLC 免疫治疗疗效的数据来源于回顾性观察性研究,样本量有限。类似地,关于 CH-IO 在 BRAF 阳性 NSCLC 中的疗效的信息很少。几项回顾性研究表明,CH-IO 对转移性 NSCLC 有一定疗效,生存结局(CH-IO 的未加权中位 OS 为 17.7 个月)与先前报道的达拉非尼联合曲美替尼的临床试验数据相似(一线治疗的中位 OS 为 17.3 个月)。
BRAF V600 突变 NSCLC 与高 TMB 和高 PD-L1 表达相关,提示这类肿瘤对基于免疫疗法的治疗更敏感。尽管我们无法证明 PD-L1 表达与 BRAF 突变状态显著相关,但观察到了这种趋势。我们还发现,3 例 BRAF 阳性肿瘤中有 2 例 TMB ≥ 20,而在 BRAF-wt 肿瘤中这一比例为 13.11%。然而,样本量小,不可能得出任何结论。此外,在任何 NADIM 试验中,TMB 与 pCR、PFS 或 OS 无关,突出了该生物标志物对 CH-IO 的效用有限。
在我们的研究中,尽管 BRAF 突变的发生率与公共数据库或先前研究中报道的非常相似,但样本量仍然较小,无法得出明确的结论,只有2例识别了 p.V600E 突变。然而,在两个完全独立的队列(NADIM 和 BLI-O)中,研究结果是一致的。关于非 V600 突变,一些研究认为其中一些突变对 MEK 和 BRAF 抑制剂有反应。同样,可以假设非 V600 突变也可以识别接受基于免疫疗法的治疗时 OS 延长的 NSCLC 患者。事实上,一例 BRAF p.G469A 突变 NSCLC 患者接受了二线纳武利尤单抗治疗,获得显著且持久的反应。
此外,观察到的生存结局与转移性黑色素瘤的结局一致。在 DREAMseq 试验中,BRAF 阳性晚期黑色素瘤患者被随机分配接受纳武利尤单抗/伊匹木单抗联合治疗或达拉非尼/曲美替尼联合治疗(靶向治疗)作为一线治疗,疾病进展后患者改用另一种联合治疗。值得注意的是,与首先接受靶向联合治疗的患者相比,首先接受免疫治疗的患者的 2 年 OS 率显著更高(72% vs 52%),提示免疫治疗疗效优于 BRAF 靶向治疗,强调了接受基于免疫疗法的治疗的 BRAF 阳性肿瘤生存结局较好。
我们的数据清楚地表明,基于免疫疗法的治疗可能为 BRAF 阳性局部晚期和晚期 NSCLC 患者带来获益。在接受 CH-IO 治疗的 NADIM 队列中观察到良好结局,包括 100% 的 pCR 率,进一步强调了新辅助 CH-IO 方法在 NSCLC 患者中的治疗价值。
参考文献:
Provencio M, Robado de Lope L, Serna-Blasco R, Nadal E, Diz Tain P, Massuti B, González-Larriba JL, Insa A, Sánchez-Hernández A, Casal-Rubio J, García-Campelo R, Sequero López S, Rogado J, Martínez-Martí A, Bosch-Barrera J, Bernabé R, Vázquez Estévez S, Ponce S, de Castro J, Coves Sarto J, Reguart N, Dómine M, Aguilar A, Majem M, Estival A, Peña Cabia S, López Martín A, Sala González MÁ, Cobo M, Camps C, Barneto I, Calvo V, Collazo-Lorduy A, Cruz-Bermúdez A, Romero A. BRAF mutational status is associated with survival outcomes in locally advanced resectable and metastatic NSCLC. Lung Cancer. 2024 Aug;194:107865. doi: 10.1016/j.lungcan.2024.107865. Epub 2024 Jun 26. PMID: 38945004.


