Molecular Neurodegeneration:中国学者揭示中脑星形胶质细胞源性神经营养因子(MANF)在阿尔茨海默病中的过表达导致突触损失
时间:2024-10-21 11:00:59 热度:37.1℃ 作者:网络
阿尔茨海默病(AD)是全球最常见的神经退行性疾病之一,其病理特征主要包括海马和皮层中的突触密度减少,以及由淀粉样蛋白斑块和过度磷酸化的Tau蛋白组成的神经纤维缠结。尽管内质网应激是阿尔茨海默病中早期的病理标志之一,但其在突触损失中的具体作用机制尚未得到充分研究。中脑星形胶质细胞源性神经营养因子(MANF)是一种非典型神经营养因子,其在内质网应激时表达增加,但它在AD中表达升高的后果仍不明确。因此,本研究旨在探讨MANF在AD中的作用,尤其是其对突触功能和神经元损伤的影响。

本研究首先在不同病理阶段的AD小鼠模型中检测MANF的表达水平,采用行为学、电生理学和神经病理学分析评估MANF转基因小鼠中的突触功能损失。通过蛋白质组学和转录组学筛选,鉴定并验证了MANF在突触功能中的分子机制。为进一步确认这些发现,研究团队还通过病毒介导的基因过表达和敲低实验,分别在野生型小鼠和5xFAD小鼠模型中验证了MANF在阿尔茨海默病中的作用。
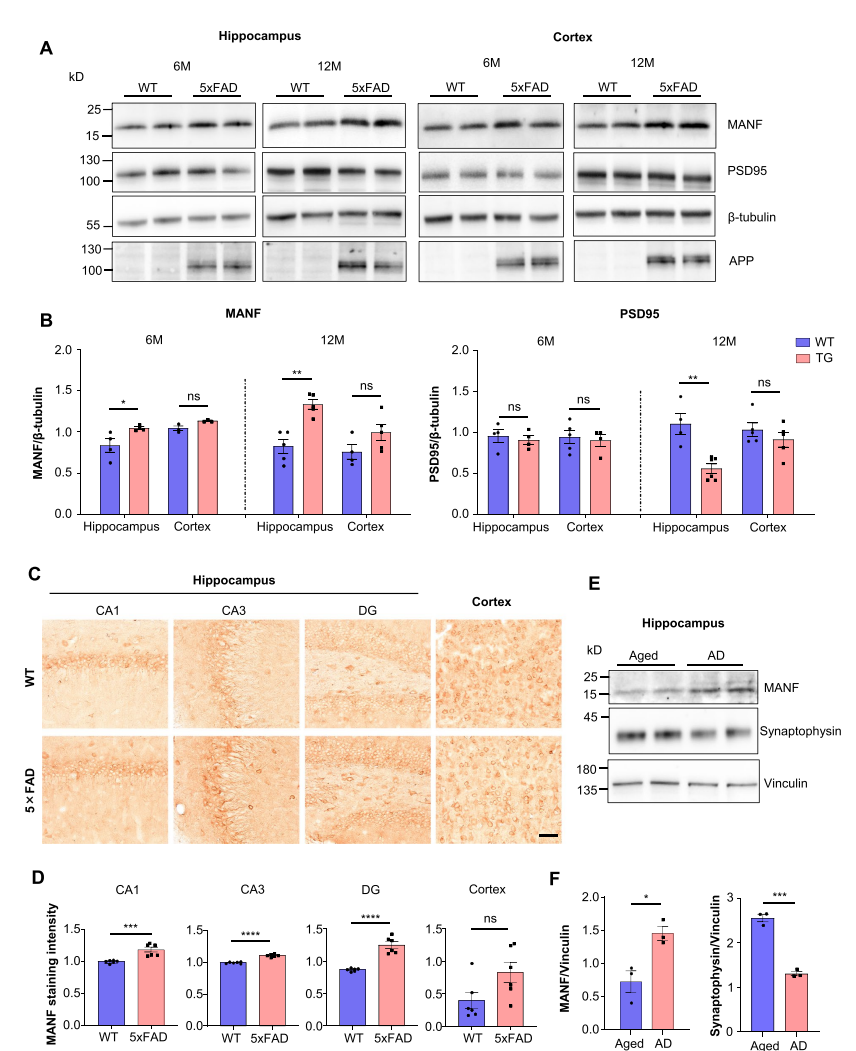
图1:MANF在阿尔茨海默病小鼠模型中与突触病理的关联
研究发现,MANF的表达水平在AD小鼠的海马中显著升高,并且与突触损失密切相关。在MANF转基因小鼠中,通过行为学测试发现这些小鼠表现出认知功能缺陷和记忆障碍,而电生理学分析显示其海马区的突触功能显著受损,表现为自发性兴奋性突触后电流(EPSC)频率的下降。通过免疫荧光染色和Western blot实验,研究团队发现MANF的过表达导致突触标志物突触素(synaptophysin)和PSD95的显著减少,提示突触密度下降。此外,Golgi染色结果显示,MANF转基因小鼠的海马区树突棘数量显著减少,这与突触损失相一致。
进一步的分子机制研究显示,MANF与RNA结合蛋白ELAVL2相互作用,影响ELAVL2对涉及突触功能的RNA转录本的结合。通过共免疫沉淀和体外结合实验,研究团队证实MANF主要通过与ELAVL2的第三个RNA识别结构域(RRM3)结合来发挥作用。RNA免疫沉淀分析表明,MANF的过表达增加了ELAVL2对多个与突触相关转录本的结合,从而影响了这些基因的稳定性和表达水平。
在阿尔茨海默病5xFAD小鼠模型中,过表达MANF加重了这些小鼠的突触病理和认知功能障碍。行为学测试显示,MANF过表达导致5xFAD小鼠在认知测试中表现更差,突触标志物的表达进一步减少,突触损失加剧。此外,过表达MANF还导致小胶质细胞活化增加,提示其可能通过增强小胶质细胞介导的突触吞噬作用加剧突触损失。相反,敲低MANF的表达则减轻了5xFAD小鼠的突触病理和行为缺陷,表现为突触标志物的表达增加,突触损失减少,认知功能恢复。
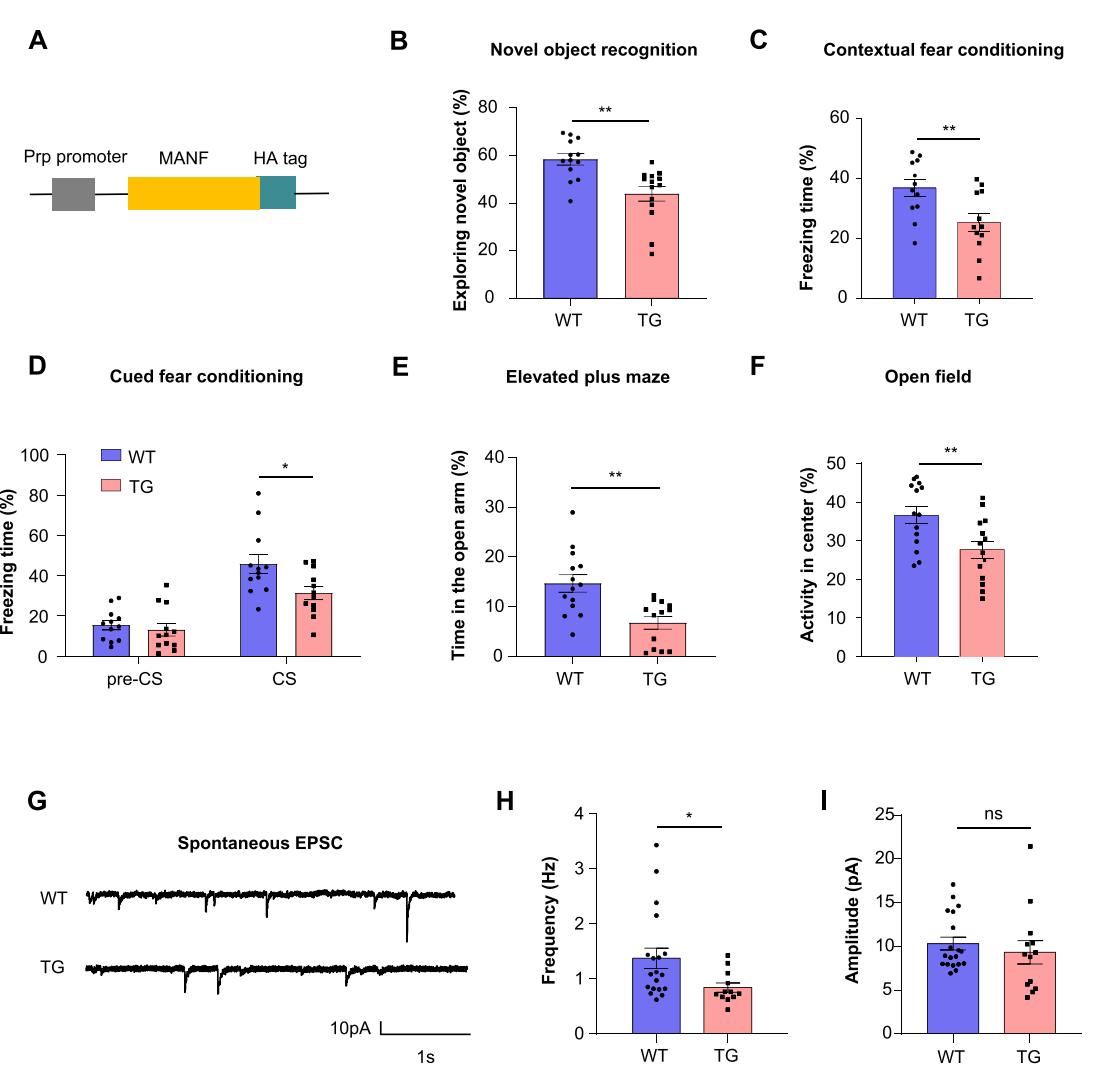
图2:MANF转基因小鼠的行为学和电生理学缺陷
本研究首次揭示了MANF在阿尔茨海默病中的双重作用。MANF的过表达通过与RNA结合蛋白ELAVL2相互作用,影响了与突触功能相关的RNA转录本的稳定性,从而导致突触损失和认知功能障碍。这一发现为阿尔茨海默病的治疗提供了新的靶点,降低MANF的表达可能成为缓解突触病理和改善认知功能的潜在治疗策略。
原始出处:
Zhang Y, Chen X, Chen L, Shao M, Zhu W, Xing T, et al. Increased expression of mesencephalic astrocyte-derived neurotrophic factor (MANF) contributes to synapse loss in Alzheimer’s disease. *Mol Neurodegeneration.* 2024;19:75. DOI: 10.1186/s13024-024-00771-3.


